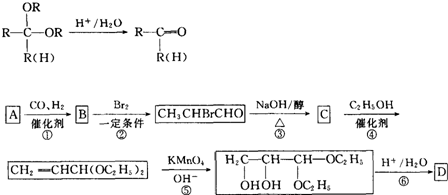
题目内容
以辉铜矿为原料火法炼铜,其原理是:2Cu2S+3O2→2Cu2O+2SO2 Cu2S+2Cu2O→6Cu+SO2↑将含3molCu2S的辉铜矿与一定量的空气(氮气、氧气的体积比4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3mol,求所得气体中的二氧化硫的体积分数.
考点:化学方程式的有关计算
专题:计算题
分析:已知2Cu2S+3O2→2Cu2O+2SO2 Cu2S+2Cu2O→6Cu+SO2↑,反应得到单质铜3mol,根据方程式计算生成二氧化硫,结合空气中氧气和氮气的含量计算.
解答:
解:将含3molCu2S的辉铜矿与一定量的空气(氮气、氧气的体积比4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3mol,
2Cu2S+3O2 →2Cu2O+2SO2
1.5mol 1mol 1mol
Cu2S+2Cu2O→6Cu+SO2↑
1mol 3mol 0.5mol
则反应消耗氧气为1.5mol,氮气的物质的量是氧气的4倍,则氮气的物质的量为6mol,
生成的二氧化硫为0.5mol+1mol=1.5mol,
则所得气体中的二氧化硫的体积分数
×100%=20%;
答:所得气体中的二氧化硫的体积分数为20%.
2Cu2S+3O2 →2Cu2O+2SO2
1.5mol 1mol 1mol
Cu2S+2Cu2O→6Cu+SO2↑
1mol 3mol 0.5mol
则反应消耗氧气为1.5mol,氮气的物质的量是氧气的4倍,则氮气的物质的量为6mol,
生成的二氧化硫为0.5mol+1mol=1.5mol,
则所得气体中的二氧化硫的体积分数
| 1.5 |
| 6+1.5 |
答:所得气体中的二氧化硫的体积分数为20%.
点评:本题考查了有关化学方程式的计算,题目难度中等,明确反应物、生成物之间物质的量关系即可计算,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
银锌(Ag-Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH.其电池总反应式为Ag2O+Zn+H2O
2Ag+Zn(OH)2,下列说法正确的是( )
| 放电 |
| 充电 |
| A、放电时Ag2O参与反应的电极为负极 |
| B、充电时阴极的电极反应为:Zn(OH)2+2e-=Zn+2OH- |
| C、放电时正极附近的pH逐渐减小 |
| D、充电时每生成1 mol Ag2O转移2 mol电子 |
在m A+n B═p C的反应中,m、n、p为各物质的计量数.现测得C每分钟增加a mol?L-1,B每分钟减少1.5a mol?L-1,A每分钟减少0.5a mol?L-1,则m:n:p为( )
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
下列电离方程式正确的是( )
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
高温下,某反应达平衡,平衡常数K=
.恒容时,温度升高,B的浓度减小.下列说法正确的是( )
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| c(C)c(D) |
| c(A)c(B) |
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| A、①③⑥ | B、①⑤ |
| C、①④⑤ | D、②⑤ |
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是:①用天平称量NaOH固体时,将NaOH放在右盘,砝码放在左盘,并移动游码使之平衡.②滴定前有气泡,滴定终点无气泡.③用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定.④用蒸馏水洗净酸滴定管后盛入标准盐酸进行滴定.⑤滴定终点读取酸滴定管数据时,仰视刻度线.( )
| A、①⑤ | B、②④⑤ |
| C、②③④⑤ | D、①②③④⑤ |
下列实验操作或装置不符合实验要求的是( )
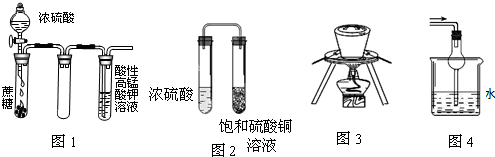

| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |