题目内容
9.某天然蛋白质充分水解后,能分离出有机物R,R可与等物质的量的KOH或HCl(由盐酸提供)完全反应,4.45gR可与50mL1mol•L-1的Na0H完全中和,则R的结构简式为( )| A. | 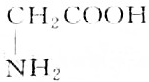 | B. | 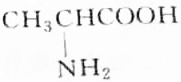 | ||
| C. | 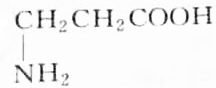 | D. | 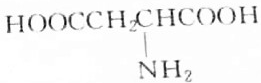 |
分析 有机物R与KOH或HCl反应时为等物质的量完全反应,说明R分子中有一个氨基(-NH2式量为16)和一个羧基(-COOH式量为45),此有机物相对分子的质量M=$\frac{4.45g}{50×1{0}^{-3}×1mol}$=89,通过式量分析:89-16-45=28,说明含有2个(CH2)或1个(CH3)和1个(CH),结合是天然蛋白质,由此分析解答.
解答 解:有机物R与KOH或HCl反应时为等物质的量完全反应,说明R分子中有一个氨基(-NH2式量为16)和一个羧基(-COOH式量为45),此有机物相对分子的质量M=$\frac{4.45g}{50×1{0}^{-3}×1mol}$=89,通过式量分析:89-16-45=28,说明含有2个(CH2)或1个(CH3)和1个(CH),对应的结构简式如B、C所示,由于天然蛋白质水解产物为a-氨基酸,故选B.
点评 本题关相对原子质量、相对分子质量的计算,有机物结构的判断等,题目难度中等,注意天然蛋白质水解产物为a-氨基酸为解答本题的关键.

练习册系列答案
相关题目
19.X、Y、Z、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和,下列叙述一定正确的是( )
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
4.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.
(2)J和氢组成10电子的化合物,其分子式为CH4.
(3)M和T的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成10电子的化合物,其分子式为CH4.
(3)M和T的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
14.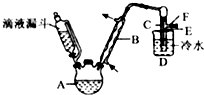 卤代烃在生产生活中具有广泛的应用,回答下列问题:
卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其分子结构为正四面体的名称为四氯甲烷;碳原子个数不大于10的烷烃分子中,其一氯代物只有一种的烷烃的个数为4个.
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构式CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料,工业生产聚氯乙烯的一种工艺路线如下:
乙烯$→_{①}^{Cl_{2}}$1,2-二氯乙烷$→_{②}^{480-530℃}$氯乙烯$\stackrel{聚合}{→}$聚氯乙烯
反应①的反应类型为加成反应;
反应②的反应类型为消去分液.
(4)实验室以乙醇、浓硫酸和溴化钠为试剂,用如图的装置制备溴乙烷,图中省去了加热装置.
有关数据见表:
①仪器B名称是球形冷凝管,仪器B的作用是冷凝回流.
②制备过程中,加入的浓硫酸必须进行稀释,其目的是AB(填序号)
A.减少副产物烯和醚的生成 B.减少Br2的生成 C.水是反应的催化剂 D.硫酸的浓度越稀反应越快
③加热应采取的方式为水浴加热;加热的目的是升高温度,加快反应速率,同时使生成的溴乙烷分离出来促进平衡右移.
④为除去收集产品中的主要杂质,应选取加入的合理试剂为Na2SO3溶液或饱和NaHSO3溶液;采用的操作是分液.
 卤代烃在生产生活中具有广泛的应用,回答下列问题:
卤代烃在生产生活中具有广泛的应用,回答下列问题:(1)多氯代甲烷常为有机溶剂,其分子结构为正四面体的名称为四氯甲烷;碳原子个数不大于10的烷烃分子中,其一氯代物只有一种的烷烃的个数为4个.
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构式CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料,工业生产聚氯乙烯的一种工艺路线如下:
乙烯$→_{①}^{Cl_{2}}$1,2-二氯乙烷$→_{②}^{480-530℃}$氯乙烯$\stackrel{聚合}{→}$聚氯乙烯
反应①的反应类型为加成反应;
反应②的反应类型为消去分液.
(4)实验室以乙醇、浓硫酸和溴化钠为试剂,用如图的装置制备溴乙烷,图中省去了加热装置.
有关数据见表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度(g/cm3) | 0.79 | 1.44 | 3.1 |
| 沸点 | 78.5 | 38.4 | 59 |
②制备过程中,加入的浓硫酸必须进行稀释,其目的是AB(填序号)
A.减少副产物烯和醚的生成 B.减少Br2的生成 C.水是反应的催化剂 D.硫酸的浓度越稀反应越快
③加热应采取的方式为水浴加热;加热的目的是升高温度,加快反应速率,同时使生成的溴乙烷分离出来促进平衡右移.
④为除去收集产品中的主要杂质,应选取加入的合理试剂为Na2SO3溶液或饱和NaHSO3溶液;采用的操作是分液.
1.根据表中部分短周期元素的原子半径和主要化合价信息判断,以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
18.下列物质的比较正确的是( )
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题: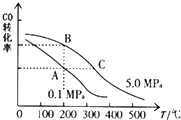 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: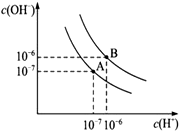 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: