题目内容
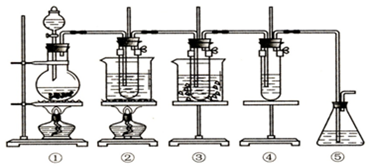
3.污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).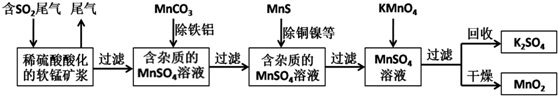
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗;其中玻璃棒的作用是引流,防止液体溅出.
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.(只用文字表述)
(3)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是6.0×10-26mol/L.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式MnO42--e-═MnO4-.
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是bc.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液
(6)废气中SO2与稀硫酸酸化的软锰矿反应的化学方程式为SO2+MnO2=MnSO4; 已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体(MnSO4•H2O,相对分子质量为169)质量为15.2kg(结果保留3位有效数字).
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,玻璃棒起引流作用;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应;
(5)准确测定一定体积燃煤尾气中SO2含量,利用其还原性及明显的反应现象分析;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰;结合硫原子守恒可知,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,过滤中玻璃棒的作用为引流,防止液体溅出,
故答案为:漏斗;引流,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{8.4×10{\;}^{-45}}{1.4×10{\;}^{-19}}$=6.0×10-26mol/L,
故答案为:6.0×10-26;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应,则阳极反应为MnO42--e-═MnO4-,故答案为:MnO42--e-═MnO4-;
(5)准确测定一定体积燃煤尾气中SO2含量,二氧化硫与氨水、NaOH反应不易控制,且加指示剂现象观察的滴定终点与反应终点误差大,而b、c中利用还原性及高锰酸钾褪色、淀粉变蓝等可准确测定气体的含量,故答案为:bc;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰,反应方程式为SO2+MnO2=MnSO4,由硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,则硫酸锰晶体的质量为$\frac{1000m{\;}^{3}×6.4g/m{\;}^{3}×90%}{64g/mol}$×169g/mol≈15.2kg,
故答案为:SO2+MnO2=MnSO4; 15.2.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 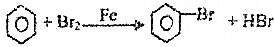 |
| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
| A. | 《西游记》中孙悟空一个“筋头云”,十万八千里,其乃“腾云驾雾”而行,其中的云不是胶体,雾是胶体 | |
| B. | 《水浒》中经典片段-----智劫生辰纲中,晁盖等人用蒙汗药药倒杨智等人.其使用的蒙汗药的主要成份可能是NaCN | |
| C. | 《三国演义》中,诸葛亮擒拿南王孟获时路遇哑泉,人饮用了哑泉水后,一个个说不出话来,其主要成份是CuSO4.智者指教,饮安乐泉水可解毒,安乐泉水主要成份可能是氢氧化钙 | |
| D. | 《红楼梦》中有经典语句:女儿是水做的骨肉,男人是泥做的骨肉.水分子间通过氢键结合而质软,泥因其主要成分是碳酸钙而质硬.这句话借此形容男女的性格差异 |
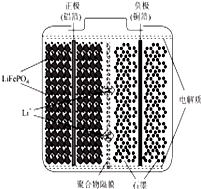 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.