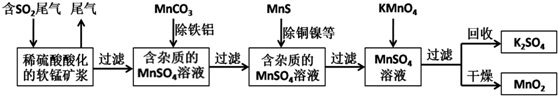
题目内容
14.金属锂是原子能工业和新能源工业中的重要物质.工业上常用β-辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下: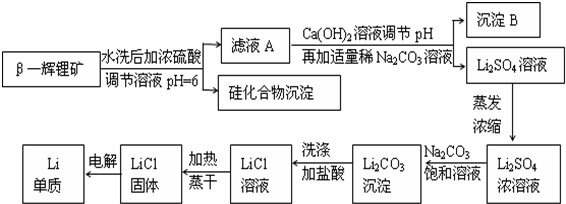
已知Li2CO3微溶于水.请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓.
(2)沉淀B的主要成分是Al(OH)3、CaCO3(写化学式).
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、酒精灯和玻璃棒.
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀.
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备.在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是SiO2+4HF=SiF4↑+2H2O(用化学反应方程式表示).
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑.若已知LiH的密度为0.82g•cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1:1148(精确到整数).
分析 本题是工业上用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧化钙和碳酸钠溶液除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂,再将溶液中锂离子转化为溶解度较小碳酸锂,加饱和Na2CO3溶液的目的是使Li+转化生成Li2CO3沉淀,通过恰当方法最终得到单质锂,
(1)LiAlSi2O6与硫酸反应,LiAlSi2O6可表示为:Li2O•Al2O3•4SiO2,依据氧化物的性质和硫酸发生的反应写出;
(2)用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧化钙和碳酸钠溶液,除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂;
(3)使用的硅酸盐质仪器是指玻璃仪器;
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是增大锂离子的浓度,在加入碳酸钠溶液后生成碳酸锂沉淀;
(5)氢氟酸与玻璃中的二氧化硅发生反应;
(6)依据密度和质量的关系计算LiH的体积,结合氢气体积计算比值.
解答 解:(1)LiAlSi2O6与硫酸反应,LiAlSi2O6可表示为:Li2O•Al2O3•4SiO2,由氧化物与硫酸的反应定量关系以及流程图中生成硅化合物沉淀可知反应的化学方程式为2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓,故答案为:2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓;
(2)用硫酸与β-锂辉矿反应,生成不溶于酸的硅化合物和含少量铝、钙、镁离子的硫酸锂溶液,然后加入氢氧根和碳酸钠溶液,除去滤液中的铝、钙、镁离子,得到较为纯净的硫酸锂,所以B沉淀为Al(OH)3、Mg(OH)2、CaCO3,由于Mg(OH)2很少量,因此主要成分是Al(OH)3、CaCO3,
故答案为:Al(OH)3、CaCO3;
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、玻璃棒、酒精灯,
故答案为:酒精灯;玻璃棒;
(4)碳酸锂微溶于水,上述生产流程中蒸发浓缩Li2SO4溶液的目的是增大锂离子的浓度,在加入碳酸钠溶液后,使锂离子浓度与碳酸根离子浓度之积大于Ksp,生成碳酸锂沉淀,
故答案为:碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀;
(5)用普通的玻璃仪器或陶瓷仪器,会和氢氟酸发生反应生成四氟化硅和水,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(6)由反应I,当吸收224LH2(10mol)时,则生成20molLiH,V=$\frac{m}{ρ}$=$\frac{20mol×8g/mol}{0.82×10{\;}^{3}g/L}$=195.1×10-3L,$\frac{V(LiH)}{V(H{\;}_{2})}$=$\frac{195.1×10{\;}^{-3}L}{224L}$=1:1148,
故答案为:1148.
点评 本题主要考查物质的分离、电解原理、盐类的水解等,难度难度较大,掌握实验的原理和流程分析是解题的关键.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 | |
| B. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| C. | 漂白粉在空气中变质是因为CaCl2与空气中的CO2反应生成 CaCO3 | |
| D. | 用热的纯碱溶液洗去油污是因为Na2CO3可直接与油脂反应 |
| A. | 碳酸钠 | B. | 乙醇 | C. | 氯化钾 | D. | 一氧化碳 |
| A. | 除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 | |
| B. | 向含少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取,以除去FeCl2溶液中的FeBr2 | |
| C. | 除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 | |
| D. | 除去CuCl2溶液中混有的少量FeCl3,可向溶液中加入CuO后再过滤 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)在①、②、③三种元素的最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号).
(4)①、③、④、⑥四种元素的离子半径由大到小的顺序依次为Al3+(填离子符号).
(5)⑦、⑧两元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式).
(6)⑥的氢化物与⑦的单质反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
| A. | Na2O2固体(稀硫酸) | B. | FeCl2溶液(KSCN溶液) | ||
| C. | KI固体(淀粉溶液) | D. | NaOH溶液(盐酸) |