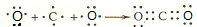题目内容
8.设NA代表阿伏加罗常数的值,下列叙述正确的是( )| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
分析 A.气体摩尔体积使用对象为气体;
B.氧气和臭氧都是由氧原子构成,依据n=$\frac{m}{M}$计算;
C.氯化铵溶液为强酸弱碱盐,水解促进水的电离;
D.二氧化硫与氧气反应生成三氧化硫为可逆反应.
解答 解:A.标况下,四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.常温常压下,6.4 g氧气和臭氧物质的量$\frac{6.4g}{16g/mol}$=0.4mol,含有的原子中物质的量为总数为0.4NA,故B正确;
C.室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-2NA,故C错误;
D.二氧化硫与氧气反应生成三氧化硫为可逆反应,一定条件下6.4gSO2与足量氧气反应生成SO3物质的量小于0.1mol,转移电子数小于0.2 NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用分析,质量换算物质的量计算微粒数,盐类水解对水电离的影响,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
2.下列有关叙述正确的是( )
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
19.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:(1)这九种元素中化学性质最不活泼的是Ar(填元素符号).
(2)在①、②、③三种元素的最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号).
(4)①、③、④、⑥四种元素的离子半径由大到小的顺序依次为Al3+(填离子符号).
(5)⑦、⑧两元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式).
(6)⑥的氢化物与⑦的单质反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)在①、②、③三种元素的最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号).
(4)①、③、④、⑥四种元素的离子半径由大到小的顺序依次为Al3+(填离子符号).
(5)⑦、⑧两元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式).
(6)⑥的氢化物与⑦的单质反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
13.常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
下列判断正确的是( )
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
20.用括号中的试剂除去各组中的杂质,不正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
17.氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)三氯化氮水解可生成氨气和物质X,X的电子式为 .
.
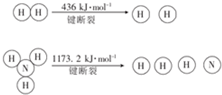
(2)已知:N2(g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1,断裂1molN≡N键需要的能量为946kJ.
(3)常温下,向amol•L-1的氨水中加入等体积bmol•L-1的盐酸,混合后溶液呈中性,则该温度下氨水的电离平衡常数为$\frac{b×1{0}^{-7}}{a-b}$(用含a和b的代数式表示).
(4)在相同温度下,向甲、乙、丙三个容积相同的恒容密闭容器中按照下列三种方式分别投料,发生反应:N2(g)+3H2 (g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
①乙容器中起始反应逆向(填“正向”“逆向”或“不”)移动.
②达到平衡时,甲、乙、丙三个容器中NH3的体积分数由大到小顺序为丙>甲=乙.
(5)现分别在150℃、300℃、500℃时向反应器中按n(N2):n(H2)=1:3投料发生反应:N2(g)+3H2 (g)?2NH3(g),该反应达到平衡时,体系中NH3的物质的量分数随压强的变化曲线如图所示.
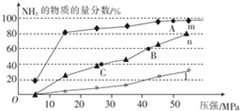
①150℃时发生的反应可用曲线m(填“m”“n”或“l”)表示.
②上图中A、B、C三点的平衡常数K的大小关系是K(A)>K(B)=K(C).
③若B点时c(NH3)=0.6mol•L-1,则此时反应的化学平衡常数K=$\frac{400}{3}$.
(1)三氯化氮水解可生成氨气和物质X,X的电子式为
 .
.(2)已知:N2(g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1,断裂1molN≡N键需要的能量为946kJ.

(3)常温下,向amol•L-1的氨水中加入等体积bmol•L-1的盐酸,混合后溶液呈中性,则该温度下氨水的电离平衡常数为$\frac{b×1{0}^{-7}}{a-b}$(用含a和b的代数式表示).
(4)在相同温度下,向甲、乙、丙三个容积相同的恒容密闭容器中按照下列三种方式分别投料,发生反应:N2(g)+3H2 (g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
②达到平衡时,甲、乙、丙三个容器中NH3的体积分数由大到小顺序为丙>甲=乙.
(5)现分别在150℃、300℃、500℃时向反应器中按n(N2):n(H2)=1:3投料发生反应:N2(g)+3H2 (g)?2NH3(g),该反应达到平衡时,体系中NH3的物质的量分数随压强的变化曲线如图所示.

①150℃时发生的反应可用曲线m(填“m”“n”或“l”)表示.
②上图中A、B、C三点的平衡常数K的大小关系是K(A)>K(B)=K(C).
③若B点时c(NH3)=0.6mol•L-1,则此时反应的化学平衡常数K=$\frac{400}{3}$.
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.