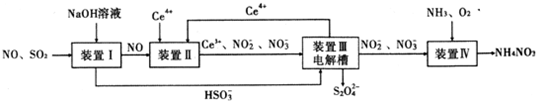
题目内容
15.实验室里可用如图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质.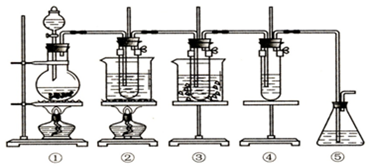
图中①为氯气发生装置;②的试管中盛有15mL 30%的KOH溶液,并置于水浴中;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管中加有紫色石蕊试液;⑤为尾气吸收装置.
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过分液漏斗.
(填写仪器名称)向烧瓶中加入适量的浓盐酸.(填写试剂名称)
(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有b(选填字母编号)的净化装置.
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)本实验制取次氯酸钠的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O.
(4)比较制取氯酸钾和次氯酸钠的条件,两者的差异是反应的温度不同、反应物浓度不同.
(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为红色,原因是氯气与水反应生成酸使石蕊显红色;接着溶液逐渐变为无色,是因为氯气与水反应生成次氯酸将石蕊氧化(或漂白)为无色.
分析 图中①为氯气发生装置MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;②的试管中盛有15mL 30%的KOH溶液,并置于水浴中,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中,氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,Cl2+2NaOH=NaClO+NaCl+H2O;④的试管中加有紫色石蕊试液,氯气与水反应生成酸使石蕊显红色,氯气与水反应生成次氯酸将石蕊氧化(或漂白)为无色;⑤为尾气吸收装置,氯气有毒,需进行尾气处理.
(1)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用分液漏斗加入浓盐酸;
(2)除去氯气中混有的氯化氢气体,可将混合气体通过饱和食盐水;
(3)氯气和碱在常温下反应生成NaClO和NaCl,以此书写反应的离子方程式;
(4)制取氯酸钾和次氯酸钠的浓度和温度不同;
(5)根据氯气与水反应生成HCl和HClO判断.
解答 解:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,图中①为氯气发生装置MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应仪器为分液漏斗和圆底烧瓶,所以用分液漏斗向盛有二氧化锰固体的圆底烧瓶中加入浓盐酸,
故答案为:分液漏斗;浓盐酸;
(2)生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:b;
(3)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,二者在水中溶解且电离,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,
故答案为:反应的温度不同、反应物浓度不同;
(5)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,
故答案为:氯气与水反应生成酸使石蕊显红色;氯气与水反应生成次氯酸将石蕊氧化为无色.
点评 本题考查氯气的制备、性质,主要是实验过程分析应用,注意物质性质的理解分析,题目难度中等,做题时注意基础知识的积累.

| A. | Na2O2固体(稀硫酸) | B. | FeCl2溶液(KSCN溶液) | ||
| C. | KI固体(淀粉溶液) | D. | NaOH溶液(盐酸) |
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
| A. |  用于分离苯和水 | B. |  用于除去Cl2中的HCl | ||
| C. |  实验室用装置制氨气 | D. |  用装置排水法收集NO |