题目内容
下列各表述与示意图一致的是( )
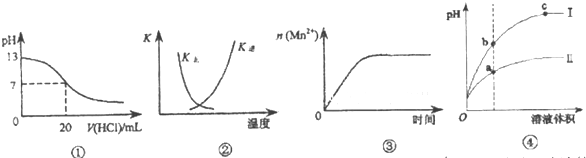

| A、图①表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B、图②中曲线表示反应:2SO2(g)+O2(g)?2SO3(g);△H<0正、逆反应的平衡常数K随温度的变化 |
| C、图③表示10 mL 0.0l mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 |
| D、I为较强酸稀释时pH变化的曲线,且b点溶液的导电性比c点溶液的导电性弱 |
考点:酸碱混合时的定性判断及有关ph的计算,氧化还原反应,化学平衡常数的含义,弱电解质在水溶液中的电离平衡
专题:
分析:A、20mL0.1mol/L的CH3COOH溶液和20mL 0.1mol/L NaOH溶液恰好反应得到的醋酸钠溶液显示碱性;
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快;
D、强酸稀释pH变化大,pH越大溶液浓度越小导电性越差.
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快;
D、强酸稀释pH变化大,pH越大溶液浓度越小导电性越差.
解答:
解:A、20mL0.1mol/L的CH3COOH溶液和20mL 0.1mol/L NaOH溶液恰好反应得到的醋酸钠溶液显示碱性,此时不会实现pH=7,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,不是恒定速率,故C错误;
D、强酸稀释pH变化大,pH越大溶液浓度越小导电性越差b点的离子浓度大于c点,所以b点溶液的导电性比c点溶液的导电性强,故D错误;
故选B:
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,不是恒定速率,故C错误;
D、强酸稀释pH变化大,pH越大溶液浓度越小导电性越差b点的离子浓度大于c点,所以b点溶液的导电性比c点溶液的导电性强,故D错误;
故选B:
点评:本题结合图象考查了中和滴定、化学平衡移动、氧化还原反应、反应中的能量变化,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、漂白精的有效成分是Ca(ClO)2 |
| B、利用高纯硅的半导体性能,可以制成光电池 |
| C、NO、NO2是大气污染物,能在空气中稳定存在 |
| D、HCl、NH3、BaSO4都是电解质 |
为确定某溶液的离子组成,进行如下实验:根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
加入正催化剂使反应速率加快,下列叙述不正确的是( )
| A、使反应体系的活化能降低 |
| B、使反应体系的活化分子总数增多 |
| C、使反应体系的活化分子百分数降低 |
| D、使反应体系的活化分子百分数增大 |

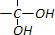
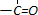
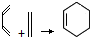
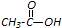
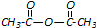
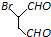 和
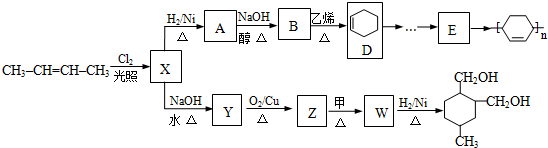
和 为原料合成
为原料合成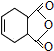 ,请设计合成路线(注明反应条件).
,请设计合成路线(注明反应条件).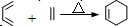

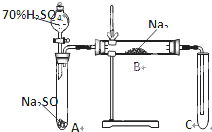 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃. 向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )
向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )