题目内容
 向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )
向某溶液A中逐滴加入或通入B物质至过量,反应过程中加入或通入B的量(用横坐标表示)与生成沉淀的量(用纵坐标表示)的关系如图所示,则符合图象的物质A与B为( )| A | B | C | D | |
| 溶液A | 澄清石灰水 | AlCl3溶液 | H2S | Na2SiO3 |
| 过量B | CO2 | KOH | SO2 | H2SO4 |
| A、A | B、B | C、C | D、D |
考点:镁、铝的重要化合物,二氧化硫的化学性质,硅和二氧化硅
专题:元素及其化合物
分析:A、澄清石灰水中通入二氧化碳,先生成沉淀,后沉淀消失;
B、氯化铝溶液中加入氢氧化钠溶液先生成沉淀,后沉淀溶解至最后消失;
C、H2S中通入二氧化硫,发生反应只生成硫沉淀;
D、Na2SiO3中滴加H2SO4溶液,发生反应只生成硅酸沉淀;
B、氯化铝溶液中加入氢氧化钠溶液先生成沉淀,后沉淀溶解至最后消失;
C、H2S中通入二氧化硫,发生反应只生成硫沉淀;
D、Na2SiO3中滴加H2SO4溶液,发生反应只生成硅酸沉淀;
解答:
解:A、石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,则生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2沉淀消失,并且生成沉淀和溶解沉淀消耗的二氧化碳为1:1,故A正确;
B、氯化铝溶液中加入氢氧化钠溶液先发生Al3++3OH-═Al(OH)3↓生成沉淀,后发生Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,并且生成沉淀和溶解沉淀消耗的二氧化碳为3:1,故B错误;
C、H2S中通入二氧化硫,发生反应2H2S+SO2═3S↓+2H2O,只生成硫沉淀,故C错误;
D、Na2SiO3中滴加H2SO4溶液,发生反应Na2SiO3+H2SO4═H2SiO3↓+Na2SO4,只生成硅酸沉淀,故D错误;
故选:A.
B、氯化铝溶液中加入氢氧化钠溶液先发生Al3++3OH-═Al(OH)3↓生成沉淀,后发生Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,并且生成沉淀和溶解沉淀消耗的二氧化碳为3:1,故B错误;
C、H2S中通入二氧化硫,发生反应2H2S+SO2═3S↓+2H2O,只生成硫沉淀,故C错误;
D、Na2SiO3中滴加H2SO4溶液,发生反应Na2SiO3+H2SO4═H2SiO3↓+Na2SO4,只生成硅酸沉淀,故D错误;
故选:A.
点评:本题考查化学反应与图象,难度较大,明确发生的化学反应及反应与图象的对应关系是解答的关键,反应发生的先后顺序是学生解答中的难点.

练习册系列答案
相关题目
下列各表述与示意图一致的是( )
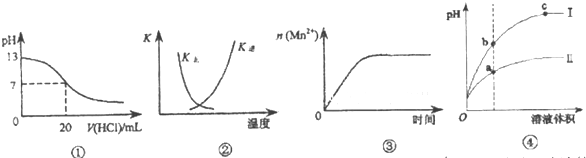

| A、图①表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B、图②中曲线表示反应:2SO2(g)+O2(g)?2SO3(g);△H<0正、逆反应的平衡常数K随温度的变化 |
| C、图③表示10 mL 0.0l mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 |
| D、I为较强酸稀释时pH变化的曲线,且b点溶液的导电性比c点溶液的导电性弱 |
在含有1mol KAl(SO4)2的明矾溶液中滴入含有2mol溶质的Ba(OH)2溶液,充分反应后,当SO42-全部转化为BaSO4沉淀时,铝元素的存在形式是( )
| A、Al(OH)3和Al3+ |
| B、Al(OH)3和AlO2- |
| C、Al3+、Al(OH)3 和AlO2- |
| D、全部为AlO2- |
有关亚硫酸的下列叙述中,不正确的是( )
| A、亚硫酸是具有漂白性能使得紫色石蕊溶液先变红后褪色 |
| B、亚硫酸不稳定,容易分解为水和SO2 |
| C、亚硫酸具有漂白性,能够使品红溶液褪色 |
| D、亚硫酸对人体有害,所以用SO2漂白过的食品不能食用 |
下列物质中,属于非电解质的是( )
| A、液态汞 | B、硫酸钡 |
| C、液氨 | D、浓硝酸 |
 如图所示,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
如图所示,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应. 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是