题目内容
16.(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:①.v(B )=3.6mol•L-1•min-1 ②.v(A )=0.15mol•L-1•s-1
③.v(C)=0.5mol•L-1•s-1 ④.v(D)=0.6mol•L-1•s-1,
该反应进行的由快到慢顺序为④>③>②>①(填序号)
(2)已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)由反应速率之比等于化学计量数之比可知,反应速率与化学计量数的比值越大,反应速率越快;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)反应速率与化学计量数的比值越大,反应速率越快,则
①$\frac{\frac{3.6}{30}}{3}$=0.04;
②$\frac{0.15}{1}$=0.15;
③$\frac{0.5}{2}$=0.25;
④$\frac{0.6}{2}$=0.3,
该反应进行的由快到慢顺序为④>③>②>①,
故答案为:④>③>②>①;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查反应速率比较及热化学反应方程式,为高频考点,把握反应速率与化学计量数的关系、反应热及键能的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-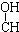 - -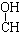 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-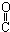 -CH2-CHO -CH2-CHO |
4.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | CO2和H2O | D. | KCl和K |
11.CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是( )
| A. | 分子间作用力,离子键 | B. | 化学键,分子间作用力 | ||
| C. | 化学键,化学键 | D. | 分子间作用力,分子间作用力 |
1.下列实验操作和结论正确的是( )
| A. | 用新制Cu(0H)2悬浊液不能鉴别麦芽糖和蔗糖 | |
| B. | 硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 | |
| C. | 油是不饱和高级脂肪酸的简单甘油酯,是纯净物 | |
| D. | 用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
8.有如下合成路线,甲经二步转化为丙:
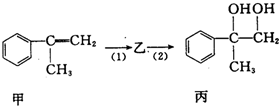
下列叙述正确的是( )
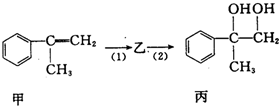
下列叙述正确的是( )
| A. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| B. | 步骤(2)产物中可能含有未反应的甲,可用酸性高锰酸钾溶液检验是否含甲 | |
| C. | 乙既能发生水解反应,又能发生消去反应 | |
| D. | 反应(1)和(2)均为取代反应 |
5.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 |
