题目内容
4.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | CO2和H2O | D. | KCl和K |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物一定含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键,以此解答.
解答 解:A.NH3是分子晶体,NH3中只含共价键;NH4Cl是离子晶体,NH4Cl中含有离子键和共价键,故A错误;
B.HCl是分子晶体,SiO2为原子晶体,故B错误;
C.H2O和CO2都是分子晶体,CO2和H2O都只含共价键,故C正确;
D.KCl为离子晶体,含有离子键,K为金属晶体,含有金属键,故D错误;
故选C.
点评 本题考查化学键类型和晶体类型的关系,注意判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键,难度不大.

练习册系列答案
相关题目
18.用惰性电极和相同电量分别电解①HCl ②KNO3 ③CuCl2 ④CuSO4四种电解质溶液,在理论上生成气体的总体积(同温同压下)由多到少的顺序是( )
| A. | ④③②① | B. | ①②③④ | C. | ④②①③ | D. | ③④①② |
15.向含SO32-、Fe2+、Br-、I-各0.1mol的混合溶液中通入Cl2,Cl2与它们可能发生如下四个反应:①SO32-+Cl2+H2=SO42-+2Cl-+2H+,②2Fe2++Cl2=2Fe3++2Cl-,③2Br-+Cl2=Br2+2Cl-,④2I-+Cl2=I2+2Cl-.当通入0.2molCl2时,发生的反应是( )
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
12.以下物质;(1)甲烷;(2)苯;(3)聚乙烯;(4)苯乙烯;(5)2-丁炔;(6)环己烷;(7)邻二甲苯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (1)(2)(3)(4)(5) | B. | (4)(5)(7)) | C. | (4)(5) | D. | (3)(4)(5)(7) |
9.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2 $?_{催化剂}^{高温高压}$2NH3(正反应是放热反应).下列有关说法正确的是( )
| A. | 达到化学反应限度时,可生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
13.下列实验可达到实验目的是( )
①溴乙烷与NaOH的醇溶液共热充分反应后,向反应混合液中滴入酸性KMnO4 溶液,若溶液颜色变浅,则证明发生了消去反应.
②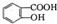 与适量NaHC03溶液反应制备
与适量NaHC03溶液反应制备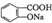
③乙酸乙酯中的少量乙酸用饱和NaOH溶液除去
④用溴水检验CH2=CH-CHO中的碳碳双键.
①溴乙烷与NaOH的醇溶液共热充分反应后,向反应混合液中滴入酸性KMnO4 溶液,若溶液颜色变浅,则证明发生了消去反应.
②
 与适量NaHC03溶液反应制备
与适量NaHC03溶液反应制备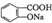
③乙酸乙酯中的少量乙酸用饱和NaOH溶液除去
④用溴水检验CH2=CH-CHO中的碳碳双键.
| A. | 只有①③④ | B. | 只有①③ | C. | 只有② | D. | 都不能 |
14.下列物质中不含非极性共价键的化合物是( )
①Na2O2 ②N2 ③CCl4 ④H2O2 ⑤NH4Br⑥Ba(OH)2.
①Na2O2 ②N2 ③CCl4 ④H2O2 ⑤NH4Br⑥Ba(OH)2.
| A. | ③⑤⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③⑤⑥ |
 .
.