题目内容
2.常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列判断错误的是( )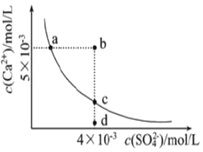
| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
分析 A.曲线上的点为溶解平衡点;
B.Ksp只与温度有关;
C.b点Qc>Ksp;
D.向d点溶液中加入适量CaCl2固体,c(Ca2+)增大.
解答 解:A.曲线上的点为溶解平衡点,则a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液,故A正确;
B.Ksp只与温度有关,a点对应的Ksp等于c点对应的Ksp,故B错误;
C.b点Qc>Ksp生成沉淀,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6,故C正确;
D.向d点溶液中加入适量CaCl2固体,c(Ca2+)增大,则可以变成c点,故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握图中平衡点、平衡移动、Ksp为解答的关键,侧重分析与应用能力的考查,注意Ksp只与温度有关,题目难度不大.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
13.在密闭容器中发生反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A. | a<c+d | B. | A的转化率增大 | ||
| C. | D的体积分数变大 | D. | 平衡向正反应方向移动 |
7.反应Am(g+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )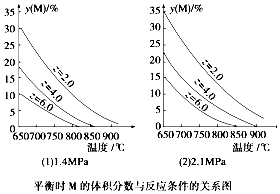

| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
11.下列说法正确的是( )
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
9.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
若某反应的平衡常数表达式为:k=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•molˉ1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
①反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=1.975;2.00min~5.00min内,O2的平均反应速率为0.055mol•Lˉ1•minˉ1.
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化
b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5)
d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O 4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-1.将一定量的NO放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
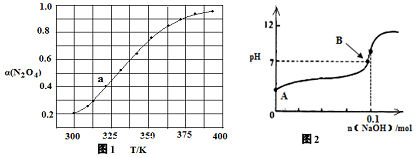
如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量0.099mol(保留两位有效数字).
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
若某反应的平衡常数表达式为:k=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,请写出此反应的热化学方程式2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•molˉ1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)?4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化
b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5)
d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O 4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-1.将一定量的NO放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量0.099mol(保留两位有效数字).
 ;氯离子的电子式
;氯离子的电子式 .
.