题目内容
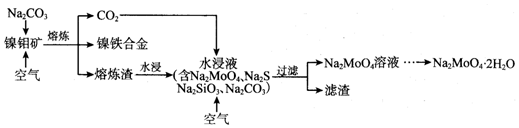
14.Ⅰ工业上用氨催化氧化制硝酸(1)由氨氧化剂制备硝酸的第一步反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O.
(2)由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循坏操作,使其充分转化为硝酸(如果不考虑生产过程中的其他损失)
①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为1:2.
②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为77.8%.
Ⅱ某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:

C装置可以加热,回答下列问题:
(3)装置图中虚线方框内必要仪器的名称和所盛试剂分别为干燥管、碱石灰.
(4)A处的玻璃导管设置成可上下抽动的原因控制氨气和氧气的体积比.
(5)实验中在D中观察到的实验现象是出现红棕色.
(6)E的作用是吸收尾气,E中倒置漏斗可防倒吸,能防倒吸原因是漏斗上方空间大,可容纳大量水,水进入漏斗中,烧杯内水面下降,与漏斗边缘脱离,漏斗中水回流至烧杯.
分析 Ⅰ.(1)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水;
(2)①氨气和氧气催化氧化生成一氧化氮和水,一氧化氮、氧气、水反应生成硝酸,根据反应方程式中氨气和氧气关系判断;
②由4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,可得:NH3+2O2=HNO3+H2O,生成1molHNO3时,水是也是1mol,据此计算;
II.A装置:氨气易挥发,空气通过氨气,控制通过气体的速率,形成氨气和氧气的混合气,B装置:除去氨气中的水蒸气,C装置:氨气催化氧化生成一氧化氮和水,D装置:
一氧化氮和氧气 反应生成二氧化氮,E装置:吸收尾气.
(3)B装置:除去氨气中的水蒸气,据此选择仪器和药品;
(4)A处的玻璃导管设置成可上下抽动,可控制通入气体的速率;
(5)D装置中一氧化氮和氧气 反应生成二氧化氮;
(6)氢氧化钠能吸收酸性气体,E中倒置漏斗,漏斗上方空间大,可缓冲防倒吸.
解答 解:Ⅰ.(1)氨气在催化作用下反应被氧化生成NO和水,化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O;
(2)①由4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,可得:NH3+2O2=HNO3+H2O,则原料氨气和氧气物质的量的投料比为1:2;
故答案为:1:2;
②由4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,可得:NH3+2O2=HNO3+H2O,则按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则生成1molHNO3时,水是也是1mol,则硝酸的质量分数为:$\frac{63}{63+18}$×100%=77.8%,
故答案为:77.8%;
II.(3)氨气为碱性气体,从浓氨水中得到的氨气含有水蒸气,需用碱性干燥剂除去,可选择碱石灰,碱石灰为固体干燥剂,可选择干燥管仪器,
故答案为:干燥管、碱石灰;
(4)A处的玻璃导管设置成可上下抽动,可通过抽动导管实现控制氨气和氧气的体积比,
故答案为:控制氨气和氧气的体积比;
(5)二氧化氮为红棕色气体,D装置中一氧化氮和氧气反应生成二氧化氮,实验现象是出现红棕色,
故答案为:出现红棕色;
(6)二氧化氮为酸性气体,能和氢氧化钠反应,2NO2+2NaOH=NaNO3+NaNO2+H2O,E的作用是吸收尾气,E中倒置漏斗,漏斗上方空间大,可容纳大量水,水进入漏斗中,烧杯内水面下降,与漏斗边缘脱离,漏斗中水回流至烧杯,
故答案为:吸收尾气;漏斗上方空间大,可容纳大量水,水进入漏斗中,烧杯内水面下降,与漏斗边缘脱离,漏斗中水回流至烧杯.
点评 本题以工业制硝酸为知识背景,掌握反应原理是解答关键,要求学生具有较强的分析问题和解决问题的能力,题目难度中等,注意(2)关系式在计算中的应用.

 名校课堂系列答案
名校课堂系列答案| A. | $\frac{V}{2}$L | B. | $\frac{V}{3}$L | C. | $\frac{5V}{6}$L | D. | VL |
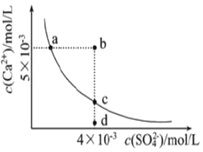
| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
| A. | 6种 | B. | 9种 | C. | 10种 | D. | 12种 |
| A. | NH3 | B. | CO2 | C. | H2 | D. | C2H4 |
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
| A. | Na+、I-、K+、Br2 | B. | Mg2+、Cu2+、SO42-、NO3- | ||
| C. | Fe2+、Cl2、K+、SO42- | D. | ClO-、Cl-、CO2、Na+ |