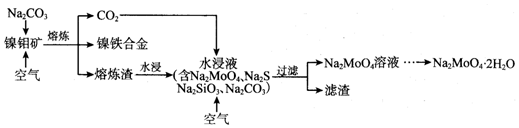
题目内容
10.已知HF的Ka=3.6×10-4,CaF2的Ksp=1.46×10-10.向1L 0.1mol•L-1的HF溶液中加入11.1g CaCl2,通过计算判断HF与CaCl2是否反应?分析 n(CaCl2)=$\frac{11.1g}{111g/mol}$=0.1mol,结合HF的Ka计算c(F-),如生成沉淀,应满足c(Ca2+)•c(F-)2>Ksp,以此解答该题.
解答 解:n(CaCl2)=$\frac{11.1g}{111g/mol}$=0.1mol,c(Ca2+)=0.1mol/L,c(F-)=$\sqrt{Ka×c(HF)}$=$\sqrt{3.6×1{0}^{-4}×0.1}$mol/L=6×10-3mol/L,
则Qc=c2(F-)•c(Ca2+)=(3.6×10-5mol/L)•0.1 mol•L-1=3.6×10-6>Ksp,说明HF与CaCl2有沉淀产生,
答:HF与CaCl2反应.
点评 本题考查了难溶物溶解平衡及其应用,为高频考点,题目难度中等,明确难溶物溶解平衡的概念及影响因素为解答关键,试题培养了学生的化学计算能力,注意判断二者能否反应的角度是判断能否生成沉淀.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. |  图中△H1=△H2+△H3 | |
| B. |  如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. |  如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
5.CO2与NO混合气体VL,通过足量Na2O2充分反应后,剩余气体体积可能为(假设NO与Na2O2不发生反应,不考虑NO2与N2O4相互转化)( )
| A. | $\frac{V}{2}$L | B. | $\frac{V}{3}$L | C. | $\frac{5V}{6}$L | D. | VL |
15.含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,则生产98%硫酸1吨,需黄铁矿的质量为( )
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
2.常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列判断错误的是( )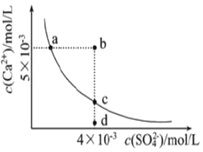

| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
18.下列指定反应的离子方程式正确的是( )
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为____________,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。