题目内容
室温下,下列溶液等体积混和,所得溶液pH的一定大于7的是( )
| A、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钠溶液 |
| B、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钡溶液 |
| C、pH=4醋酸溶液和pH=10氢氧化钠溶液 |
| D、pH=4盐酸溶液和pH=10氢氧化钡溶液 |
考点:pH的简单计算,溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:A.二者恰好反应,反应方程式为HCl+NaOH=NaCl+H2O;
B.二者反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O;
C.室温下,pH=4的醋酸浓度大于pH=10NaOH溶液浓度,二者等体积混合醋酸有剩余;
D.pH=4的盐酸中c(H+)等于pH=10的Ba(OH)2中c(OH-),二者等体积混合时恰好反应生成氯化钡和水.
B.二者反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O;
C.室温下,pH=4的醋酸浓度大于pH=10NaOH溶液浓度,二者等体积混合醋酸有剩余;
D.pH=4的盐酸中c(H+)等于pH=10的Ba(OH)2中c(OH-),二者等体积混合时恰好反应生成氯化钡和水.
解答:
解:A.二者恰好发生反应HCl+NaOH=NaCl+H2O,生成强酸强碱盐NaCl,溶液呈中性,则pH=7,故A错误;
B.二者反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O,根据方程式知,Ba(OH)2有剩余,溶液呈碱性,则pH>7,故B正确;
C.室温下,pH=4的醋酸浓度大于pH=10NaOH溶液浓度,二者等体积混合醋酸有剩余,溶液呈酸性,则pH<7,故C错误;
D.pH=4的盐酸中c(H+)等于pH=10的Ba(OH)2中c(OH-),二者等体积混合时恰好反应生成氯化钡和水,氯化钡为强酸强碱盐,溶液呈中性,则pH=7,故D错误;
故选B.
B.二者反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O,根据方程式知,Ba(OH)2有剩余,溶液呈碱性,则pH>7,故B正确;
C.室温下,pH=4的醋酸浓度大于pH=10NaOH溶液浓度,二者等体积混合醋酸有剩余,溶液呈酸性,则pH<7,故C错误;
D.pH=4的盐酸中c(H+)等于pH=10的Ba(OH)2中c(OH-),二者等体积混合时恰好反应生成氯化钡和水,氯化钡为强酸强碱盐,溶液呈中性,则pH=7,故D错误;
故选B.
点评:本题考查了溶液酸碱性判断,根据溶液中的溶质及其性质确定溶液酸碱性,知道溶液酸碱性要根据溶液中氢离子和氢氧根离子相对大小判断,不能根据pH大小判断,为易错点.

练习册系列答案
相关题目
下列计算结果不正确的是( )
A、将标准状况下的a L氯化氢溶于1L水中.所得溶液的密度为d g/mL.则所得溶液的物质的量浓度为
| ||
| B、500mL氯化铁和氯化铜的混合溶液.其中含有0.2mol Fe3+和1.0mol的Cl-.其余是Cu2+,向其中加人足量的铁粉.充分反应后的溶液中含有Fe2+的物质的量为0.5mol | ||
| C、室温下,Mg(OH)2的Ksp=3.2×10-11.则室温时饱和Mg(OH)2溶液的pH=10.6 | ||
| D、一定量的CH4在不足量的氧气中燃烧,产生7.2g水,转移了1.4NA个电子.则燃烧产物中CO与CO2的物质的量之比为1:1 |
能正确表示下列反应的离子方程式是( )
| A、少量的CO2通人氨水中:CO2+NH3?H2O═NH4++HCO3- | ||||
| B、Na2O2溶于水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | ||||
| C、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | ||||
D、用惰性电极电解熔融氯化钠:2Cl-+2H2O
|
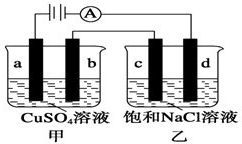 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
下列关于金属腐蚀的叙述不正确的是( )
A、金属在潮湿情况下的腐蚀实质是M+nH2O=M(OH)n+
| ||
| B、金属的化学腐蚀实质是M-ne-=Mn+,电子直接转移给氧化剂 | ||
| C、在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀 | ||
| D、防止金属发生电化学腐蚀,关键在于阻止金属成为原电池的负极,避免其发生阳极氧化而溶解. |
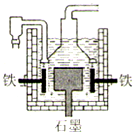 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:Ⅰ:4NaOH(熔融)
| ||
Ⅱ:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑
Ⅲ:3NaCl(熔融)
| ||
下列有关说法正确的是( )
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |
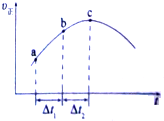 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容: