题目内容
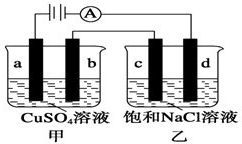 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序,则甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;甲中发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑,以此来解答.
| ||
| ||
解答:
解:A.a为电解池阳极,发生4OH--4e-=O2↑+2H2O,故A正确;
B.乙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑,通入适量HCl气体,溶液组成可以恢复,加入盐酸会导致溶液溶中溶剂水增多,不能回复原溶液组成,故B错误;
C.乙中d电极反应为:2H2O+2e-=2OH-+H2↑,d极附近溶液呈碱性,则电解时向乙中滴入酚酞试剂,d电极附近变红,故C正确;
D.当b极有6.4g Cu析出时,根据2Cu2++4e-=2Cu可知转移0.2mol电子,c电极发生4Cl--4e-=2Cl2↑,则生成氯气0.1mol,质量为7.1g,故D正确,
故选B.
B.乙中发生2NaCl+2H2O
| ||
C.乙中d电极反应为:2H2O+2e-=2OH-+H2↑,d极附近溶液呈碱性,则电解时向乙中滴入酚酞试剂,d电极附近变红,故C正确;
D.当b极有6.4g Cu析出时,根据2Cu2++4e-=2Cu可知转移0.2mol电子,c电极发生4Cl--4e-=2Cl2↑,则生成氯气0.1mol,质量为7.1g,故D正确,
故选B.
点评:本题考查电解池的工作原理应用,涉及电极判断、电极反应书写、电子转移的计算应用等,明确两个烧杯中的电极反应是解答本题的关键,并注意装置特点及电子守恒来解答,题目难度不大.

练习册系列答案
相关题目
有机物A是农药生产中的一种中间体,结构简式如下所示.下列叙述中正确的是( )


| A、1mol A最多能与4mol H2发生加成反应 |
| B、有机物A与浓硫酸混合加热,可以发生消去反应 |
| C、有机物A可以在一定条件下与HBr发生反应 |
| D、1mol A与足量的NaOH溶液反应,消耗NaOH的物质的量为2mol |
1mol石膏(CaSO4?2H2O)加热到150℃,失去大部分结晶水变成熟石膏(2CaSO4?H2O),在此过程中失去结晶水的物质的量为( )
| A、2mol |
| B、1.5mol |
| C、1mol |
| D、0.5mol |
 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.其水溶液中FeO
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.其水溶液中FeO2- 4 |
| A、不论溶液酸碱性如何变化,铁元素都有4种存在形态 |
| B、向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先减小后增大 |
| C、pH=2的这种溶液中存在如下等式关系:2[K+]=[H3FeO4+]+[H2FeO4]+[HFeO4-] |
| D、pH=8的这种溶液中存在如下等式关系:[K+]+[H+]=[OH-]+[HFeO4-]+2[FeO42-] |
VmL硫酸铁溶液中含a g Fe3+,从该溶液中取出
mL,并稀释至2VmL,则稀释后溶液中的SO42-物质的量浓度约为( )
| V |
| 2 |
A、
| ||
B、
| ||
C、
| ||
D、
|
某固体物质W在一定条件下加热分解:2W
X+2Y+4Z,已知生成物均为气体.现测得生成的混合气体在标准状况下250毫升的质量为0.255克,W的式量约为( )
| ||
| A、79.97 |
| B、22.85 |
| C、159.91 |
| D、45.69 |
室温下,下列溶液等体积混和,所得溶液pH的一定大于7的是( )
| A、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钠溶液 |
| B、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钡溶液 |
| C、pH=4醋酸溶液和pH=10氢氧化钠溶液 |
| D、pH=4盐酸溶液和pH=10氢氧化钡溶液 |
3mol SO32-恰好将1mol RO4-还原,SO32-被氧化为SO42-.则RO4-在产物中将转化成( )
| A、R2+ |
| B、R+ |
| C、R3+ |
| D、R4+ |