题目内容
14.某温度下,SO3(g)?SO2(g)+$\frac{1}{2}$O2(g)△H=+98 kJ•mol-1.开始时在10L的密闭容器中加入0.40mol SO2和 1.00mol O2(g),当反达到平衡时共放出热量19.6kJ,该温度下平衡常数K=$\frac{10}{3}$.分析 某温度下,SO3(g)?SO2(g)+$\frac{1}{2}$O2(g)△H=+98 kJ•mol-1.可知SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98 kJ•mol-1,当反达到平衡时共放出热量19.6kJ,可知消耗SO2的物质的量为$\frac{19.6kJ}{98kj/mol}$=0.2mol,以此计算平衡时各物质的浓度,则可计算平衡常数.
解答 解:某温度下,SO3(g)?SO2(g)+$\frac{1}{2}$O2(g);△H=+98 kJ•mol-1.可知SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98 kJ•mol-1,当反达到平衡时共放出热量19.6kJ,可知消耗SO2的物质的量为$\frac{19.6kJ}{98kj/mol}$=0.2mol,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
起始(mol)0.40 1.00 0
转化(mol)0.20 0.10 0.20
平衡(mol)0.20 0.90 0.20
平衡浓度(mol/L) 0.02 0.09 0.02
则K=$\frac{0.02}{0.02×0.0{9}^{\frac{1}{2}}}$=$\frac{10}{3}$.
故答案为:$\frac{10}{3}$.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及平衡常数计算,比较基础.

练习册系列答案
相关题目
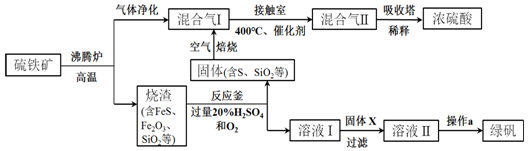
4.某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
(1)仪器A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;装置B中的试剂是饱和食盐水.
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
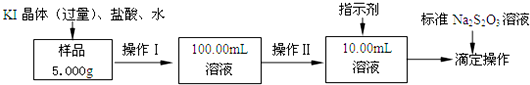
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mo1•L-1Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理,:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑ I2+2S2O32-═2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol•L-1,Ka (CH3COOH)=1.7×10-5mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mo1•L-1Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理,:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑ I2+2S2O32-═2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol•L-1,Ka (CH3COOH)=1.7×10-5mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
5. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: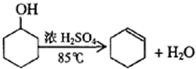
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
2.对于反应X(g)+Y(g)?3Z(g)(正反应为吸热反应),下列可作为平衡状态的标志的是( )
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
19.下列各组无色溶液的离子组在pH=l时能大量共存的是( )
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
6.下列物质不能和NaOH发生反应的是( )
| A. | 阿司匹林 | B. | 醋酸 | C. | 小苏打 | D. | 苏打 |
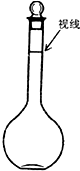 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有: