题目内容
3.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 9gD2O 中含有的电子数为 5NA | |
| B. | 92gNO2和 N2O4混合气体中含有原子数为 6NA | |
| C. | 1molC3H8分子中共价键总数为 8 NA | |
| D. | 65 g Zn 全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为 NA |
分析 A、求出重水的物质的量,然后根据重水中含10个电子来分析;
B、NO2和 N2O4的最简式均为NO2;
C、C3H8分子中含8条C-H键和2条C-C键;
D、求出锌的物质的量,然后根据锌反应后变为+2价来分析.
解答 解:A、9g重水的物质的量为0.45mol,而重水中含10个电子,故0.45mol重水中含4.5NA个电子,故A错误;
B、NO2和 N2O4的最简式均为NO2,故92g混合物中含NO2的物质的量为2mol,故含6NA个原子,故B正确;
C、C3H8分子中含8条C-H键和2条C-C键,故1mol丙烷中含10NA条共价键,故C错误;
D、65g锌的物质的量为1mol,而锌反应后变为+2价,故1mol锌反应后转移2NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
13.下列各组稀溶液,只用试管和胶头滴管不能鉴别的是( )
| A. | AlCl3和KOH | B. | Na2CO3和盐酸 | C. | NaAl(OH)4和盐酸 | D. | AlCl3和氨水 |
14.下列有关性质的比较中,正确的是( )
| A. | 酸性:HClO>H2CO3 | B. | 电负性:N>O>C | ||
| C. | 晶体熔点的高低: | D. | 稳定性:H2O<NH3<PH3<SiH4 |
11.下列物质不能直接化合得到的是( )
| A. | FeCl2 | B. | Na2S | C. | Fe(OH)3 | D. | CuS |
18.下列离子方程式的书写正确的是( )
| A. | 铁和氯化铁反应:Fe+Fe3+=2Fe2+ | |
| B. | Ca(HCO3)2溶液与NaOH溶液反应:OH-+HCO3-=H2O+CO32- | |
| C. | 氯气和水反应:Cl2+H2O=H++Cl-+HClO | |
| D. | FeCl3和KSCN的反应:Fe3++3SCN-=Fe(SCN)3↓ |
8.下列说法不正确的是( )
| A. | 二氧化碳通入饱和碳酸钠溶液会有固体析出 | |
| B. | 用PH计测得某碱性溶液的pH为12.5 | |
| C. | 量取10.00ml水可以用滴定管或量筒 | |
| D. | 除去氯气中混有的氯化氢可通入饱和食盐水 |
15.下列卤代烃不能发生消去反应的是( )
| A. |  | B. | CH3CH2Cl | ||
| C. | (CH3)2 CHBr | D. | (CH3)3 CCH2Br |
13.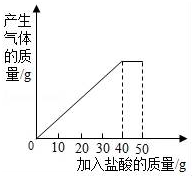 石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
请计算:
(1)石灰石样品中杂质的质量为4g;
(2)所加盐酸的溶质质量分数.
 石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
(1)石灰石样品中杂质的质量为4g;
(2)所加盐酸的溶质质量分数.
