题目内容
18.下列各组物质的溶液,不加任何其他试剂,就能将其一一区别出来的是( )| A. | NaCl、Na2CO3、Ba(NO3)2、H2SO4 | B. | BaCl2、CuSO4、NaOH、NaCl | ||
| C. | NaCl、NaOH、H2SO4、Ba(NO3)2 | D. | K2SO4、BaCl2、K2CO3、KNO3 |
分析 A.硫酸与碳酸钠反应生成气体,与硝酸钡反应生成沉淀,与NaCl不反应;Ba(NO3)2与Na2CO3、H2SO4反应均生成沉淀;
B.硫酸铜为蓝色,与硫酸铜生成蓝色沉淀的为NaOH,生成白色沉淀的为氯化钡;
C.H2SO4、Ba(NO3)2反应生成白色沉淀,其它物质混合现象不明显;
D.BaCl2与K2SO4、K2CO3反应均生成白色沉淀.
解答 解:A.硫酸与碳酸钠反应生成气体,与硝酸钡反应生成沉淀,与NaCl不反应;Ba(NO3)2与Na2CO3、H2SO4反应均生成沉淀,则不用其它试剂可鉴别,故A正确;
B.硫酸铜为蓝色,与硫酸铜生成蓝色沉淀的为NaOH,生成白色沉淀的为氯化钡,最后可知NaCl,不用其它试剂可鉴别,故B正确;
C.H2SO4、Ba(NO3)2反应生成白色沉淀,其它物质混合现象不明显,不能鉴别,故C错误;
D.BaCl2与K2SO4、K2CO3反应均生成白色沉淀,均与硝酸钾不反应,不能鉴别,故D错误;
故选AB.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 二氧化碳通入饱和碳酸钠溶液会有固体析出 | |
| B. | 用PH计测得某碱性溶液的pH为12.5 | |
| C. | 量取10.00ml水可以用滴定管或量筒 | |
| D. | 除去氯气中混有的氯化氢可通入饱和食盐水 |
9.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 加入铝粉能产生氢气的溶液:NH4+、K+、HCO3-、Br- | |
| B. | 含有KSCN的溶液:Na+、Fe3+、SO32-、OH- | |
| C. | c(KNO3)为1.0mol•L-1的溶液:H+、Fe2+、Cl-、SO42- | |
| D. | pH=14的溶液:Na+、K+、NO3-、AlO2- |
6.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:Li>Na>K>Rb |
13.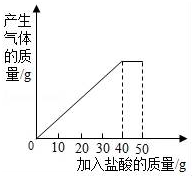 石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
请计算:
(1)石灰石样品中杂质的质量为4g;
(2)所加盐酸的溶质质量分数.
 石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
(1)石灰石样品中杂质的质量为4g;
(2)所加盐酸的溶质质量分数.
10.20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是( )
| A. | 杜绝污染源 | B. | 治理污染点 | C. | 处理废弃物 | D. | 减少有毒物 |
7.下列有关说法正确的是( )
| A. | 漂白精和明矾都常用于自来水的处理,二者作用原理相同 | |
| B. | 用SO2漂白纸浆和草帽 | |
| C. | 存放NaOH溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | |
| D. | 硅是一种良好的半导体材料,所以是制造光导纤维的基本原料 |
1.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | M的气态氢化物比N的气态氢化物稳定 | |
| B. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| C. | M与X形成的化合物对应的水化物一定是强酸 | |
| D. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示: