题目内容
15.将少量铝粉投入下列物质中,充分反应后无固体残留的是( )| A. | 热的纯水 | B. | 热的烧碱 | C. | 冷的浓硫酸 | D. | 冷的硫酸铜溶液 |
分析 A.铝和热水发生微弱反应,铝不能全部反应;
B.铝在热碱中反应生成偏铝酸钠和氢气;
C.铝在冷的浓硫酸中发生钝化现象;
D.冷的硫酸铜溶液中铝反应置换出金属固体铜.
解答 解:A.热的纯水和铝发生微弱反应,铝不能全部反应,故A错误;
B.铝在热碱中反应生成偏铝酸钠和氢气,金属铝可以全部溶解,溶液中无固体残留,故B正确;
C.铝在冷的浓硫酸中发生钝化现象,不能溶解,故C错误;
D.冷的硫酸铜溶液中加入铝粉,发生置换反应生成铜,溶液中有固体残留,故D错误;
故选B.
点评 本题考查了物质性质、物质变化、物质特征性质的积累和反应过程分析判断,注意常温下铝在浓硫酸中的钝化现象,题目难度不大.

练习册系列答案
相关题目
5. 若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
 若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-) | |
| C. | 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D | |
| D. | C点时加入盐酸溶液的体积等于10 mL |
6.将1.35g铝用60mL 3mol/L的盐酸完全溶解后,向其中加入 200mL1mol/L的NaOH溶液,可生成沉淀的物质的量为( )
| A. | 0.02mol | B. | 0.03mol | C. | 0.05mol | D. | 0.17mol |
3.氢硫酸中加入或通入少量下列物质,溶液酸性增强的是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | NaOH |
10.青铜是我国使用最早的合金.下列关于青铜性质的说法错误的是( )
| A. | 硬度比纯铜小 | B. | 能够导电 | C. | 能够导热 | D. | 熔点比纯铜低 |
7.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
4.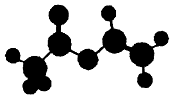 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
5.电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
③上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为1×10-5.
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
②实验步骤:
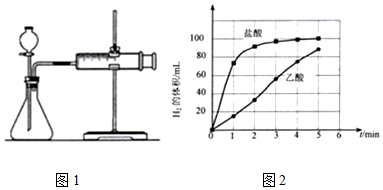
a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |

a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
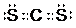 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.