题目内容
叠氮化钠(NaN3)是一种无色结晶,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O=NaN3+NaOH+NH3、3NaNH2+NaNO3=NaN3+3NaOH+NH3↑
(1)下列说法正确的是 .
A.N3-与N2O互为等电子体
B.NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因: .
(3)依据价层电子对互斥理论,NO3-空间构型呈 形.
2NaNH2+N2O=NaN3+NaOH+NH3、3NaNH2+NaNO3=NaN3+3NaOH+NH3↑
(1)下列说法正确的是
A.N3-与N2O互为等电子体
B.NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因:
(3)依据价层电子对互斥理论,NO3-空间构型呈
考点:氢键的存在对物质性质的影响,判断简单分子或离子的构型,“等电子原理”的应用,晶体的类型与物质熔点、硬度、导电性等的关系
专题:
分析:(1)A.原子数相同,电子数目相同的微粒为等电子体;
B.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,共价化合物中只含共价键;
C.离子晶体中阴阳离子电荷越多,半径越小,熔点越高;
(2)氢键使物质的熔沸点升高;
(3)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
B.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,共价化合物中只含共价键;
C.离子晶体中阴阳离子电荷越多,半径越小,熔点越高;
(2)氢键使物质的熔沸点升高;
(3)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
解答:
解:A(1)A.N3-与N2O原子数相同,电子数目相同,互为等电子体,故A正确;
B.NaN3、NaNH2、NaOH、NaNO3含有离子键,均为离子化合物,故B正确;
C.阴阳离子电荷越多,半径越小,熔点越高,与相对分子质量无关,故C错误;
故答案为:AB;
(2)氨气分子间存在氢键,氢键使物质的熔沸点升高,N2O分子间只有范德华力,氢键的作用力大于范德华力;
故答案为:前者分子间以较强氢键结合,后者以较弱的范德华力结合;
(3)NO3-中价层电子对个数=σ键个数+孤电子对个数=3+
(6-3×2)=3,所以其空间构型为平面正三角形,故答案为:平面正三角.
B.NaN3、NaNH2、NaOH、NaNO3含有离子键,均为离子化合物,故B正确;
C.阴阳离子电荷越多,半径越小,熔点越高,与相对分子质量无关,故C错误;
故答案为:AB;
(2)氨气分子间存在氢键,氢键使物质的熔沸点升高,N2O分子间只有范德华力,氢键的作用力大于范德华力;
故答案为:前者分子间以较强氢键结合,后者以较弱的范德华力结合;
(3)NO3-中价层电子对个数=σ键个数+孤电子对个数=3+
| 1 |
| 2 |
点评:本题考查内容较多,是一道综合题,涉及化学键类型、晶体的熔点比较、等电子体、杂化轨道、氢键等,题目难度中等,注意对基础知识的归纳整理.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列粒子在溶液中能大量共存的是( )
| A、K+、NO3-、I-、H2SO3 |
| B、Na+、Fe3+、NO3-、CO32- |
| C、Al3+、NO3-、SO32-、OH- |
| D、NH4+、Na+、SO42-、CH3COOH |
下列物质中,只含有离子键的是( )
| A、H2O |
| B、CO2 |
| C、MgCl2 |
| D、KOH |
CO2+NH3+H20+A═NaHCO3↓+NH4Cl是侯氏制碱法的重要反应,反应中物质A的化学式为( )
| A、Na2O |
| B、NaCl |
| C、NaOH |
| D、Na2CO3 |
设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
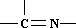 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是