题目内容
25℃,NaOH和Na2CO3两溶液的pH均为11.
(1)两溶液中,由水电离的c(OH-)分别是:①NaOH溶液中 ;②Na2CO3溶液中 .
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是 (填化学式)溶液.
(3)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案 .
(1)两溶液中,由水电离的c(OH-)分别是:①NaOH溶液中
(2)各取10mL上述两种溶液,分别加水稀释到100mL,pH变化较大的是
(3)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)①氢氧化钠溶液中的氢离子是水电离的,据此计算出pH=11的氢氧化钠溶液中水电离的氢氧根离子;
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,碳酸钠溶液中氢氧根离子是水电离的;
(2)加水稀释后,氢氧化钠为强电解质,氢氧根离子浓度变为原先的
,而碳酸钠溶液中碳酸根离子的水解程度增大,氢氧根离子浓度变化较小;
(3)用酚酞和氯化钡溶液设计实验方案检验.
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,碳酸钠溶液中氢氧根离子是水电离的;
(2)加水稀释后,氢氧化钠为强电解质,氢氧根离子浓度变为原先的
| 1 |
| 100 |
(3)用酚酞和氯化钡溶液设计实验方案检验.
解答:
解:(1)pH=11,溶液中氢氧根离子浓度为:c(OH-)=1.0×10-3mol/L,
①氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则氢氧化钠溶液中水电离的氢氧根离子浓度为:1.0×10-11mol/L,
故答案为:1.0×10-11mol/L;
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢氧根离子浓度为:c(OH-)=
mol/L=1.0×10-3mol/L,
故答案为:1.0×10-3mol/L;
(2)氢氧化钠为强电解质,溶液中完全电离,碳酸根离子的是水解为可逆反应,则溶液稀释后,氢氧化钠溶液的pH变化较大,碳酸钠溶液的pH变化较小,
故答案为:NaOH;
(3)探究纯碱溶液呈碱性是由CO32-引起的方法为:向纯碱溶液中滴入酚酞溶液,溶液显红色,若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的,
故答案为:向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的.
①氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则氢氧化钠溶液中水电离的氢氧根离子浓度为:1.0×10-11mol/L,
故答案为:1.0×10-11mol/L;
②碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢氧根离子浓度为:c(OH-)=
| 1×10-14 |
| 1×10-11 |
故答案为:1.0×10-3mol/L;
(2)氢氧化钠为强电解质,溶液中完全电离,碳酸根离子的是水解为可逆反应,则溶液稀释后,氢氧化钠溶液的pH变化较大,碳酸钠溶液的pH变化较小,
故答案为:NaOH;
(3)探究纯碱溶液呈碱性是由CO32-引起的方法为:向纯碱溶液中滴入酚酞溶液,溶液显红色,若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的,
故答案为:向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO32-引起的.
点评:本题考查了酸碱混合的定性判断、溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确水的电离及其影响因素,明确酸碱溶液抑制了水的电离、能够水解的盐溶液促进了水的电离.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
关于食物的酸碱性说法错误的是( )
| A、蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
| B、葡萄吃起来是酸的,故它属于酸性食物 |
| C、食物的酸碱性与化学上所指溶液的酸碱性不同的 |
| D、正常情况下,人体血液的pH总保持弱碱性范围 |
下列变化过程,属于放热过程的是( )
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧
⑥弱酸电离
⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧
⑥弱酸电离
⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌.
| A、②③④ | B、①⑥⑦ |
| C、①③⑤ | D、②③④⑤ |
若50滴水正好是mmL,则1滴水所含的分子数是( )
| A、m×50×18×6.02×1023 | ||
B、
| ||
C、
| ||
D、
|
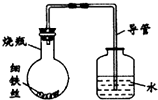 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.