题目内容
8.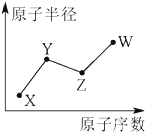 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
分析 X、Y、Z、W是四种常见的短周期主族元素,Y是形成化合物种类最多的元素,则Y为C元素;X的原子序数和半径均不C小,所以X为H元素;Z与X可形成两种常温下液态的化合物,可推知Z为O;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;结合元素化合物性质解答.
解答 解:X、Y、Z、W是四种常见的短周期主族元素,Y是形成化合物种类最多的元素,则Y为C元素;X的原子序数和半径均不C小,所以X为H元素;Z与X可形成两种常温下液态的化合物,可推知Z为O;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;
A.C、O、Cl三种元素,可以形成CO、CO2、CCl4、ClO2等化合物,故A错误;
B.H、C、O三种元素,可以形成很多种有机物和无机物,所以形成的化合物超过8种,故B正确;
C.C的含氧酸的酸性可能大于Cl的含氧酸的酸性,如H2CO3>HClO,故C错误;
D.1molX、Y两种元素形成的化合物有多种,如CH4、C2H4等,1molC2H4完全燃烧消耗3mol氧气,故D错误.
故选B.
点评 本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
18.铁在工业和生活中都具有非常重要的应用.某含铁化合物W,为探究其成分,化学兴趣小组的同学取化合物W粉末进行试验.经组成分析,该粉末除Fe外还有O和另一未知元素共三种元素.另取2.22g化合物W的粉末溶于适量稀硫酸,向反应后的溶液中加入含有3.20gNaOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色粉末1.60g;将所得滤液在一定条件下蒸发灼烧可得到一种纯净的不含结晶水的盐7.10g.请回答:
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:CoC2O4(s)?CoO(s)+CO(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
由表中数据,列式计算250℃时CoC2O4分解平衡常数2.89×10-6.该反应的焓变△H>0(填“>”、“=”或“<”).
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
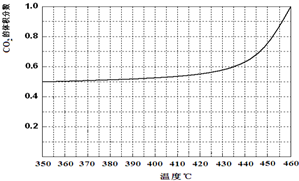
试画出CO的体积分数随温度变化的曲线 .
.
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:CoC2O4(s)?CoO(s)+CO(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:

试画出CO的体积分数随温度变化的曲线
 .
.
19.下列说法中正确的是( )
| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
16.下列有关说法错误的是( )
| A. | X-衍射实验可以区分晶体和非晶体 | B. | SiO2属于原子晶体 | ||
| C. | 金属钋是简单立方堆积 | D. | 晶格能的大小只与离子半径有关 |
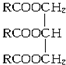 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.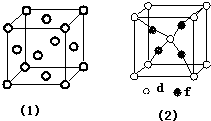 周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;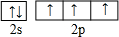 ,f在周期表中的位置是第四周期第IB族
,f在周期表中的位置是第四周期第IB族 .
. .
. 或
或 或
或 .
.