题目内容
16.下列有关说法错误的是( )| A. | X-衍射实验可以区分晶体和非晶体 | B. | SiO2属于原子晶体 | ||
| C. | 金属钋是简单立方堆积 | D. | 晶格能的大小只与离子半径有关 |
分析 A.晶体对X-射线发生衍射,非晶体不会对X-射线发生衍射;
B.二氧化硅中原子间通过共价键形成空间网状结构;
C.Po属于简单立方堆积,晶胞图为 ;
;
D.金属离子的电荷越多,离子半径越小,晶格能越大.
解答 解:A.晶体对X-射线发生衍射,非晶体不会对X-射线发生衍射,所以能用X-射线衍射技术可以区分晶体和非晶体,故A正确;
B.二氧化硅中O原子与Si原子间通过共价键形成空间网状结构,属于原子晶体,故B正确;
C.Po属于简单立方堆积,原子位于立方体的顶点上,其晶胞图为 ,故C正确;
,故C正确;
D.金属离子的电荷越多,离子半径越小,晶格能越大,所以晶格能的大小与离子半径、以及离子所带电荷多少有关,故D错误.
故选D.
点评 本题考查了晶体非晶体的鉴别、原子晶体的判断、晶胞的堆积方式、决定晶格能的因素,题目难度不大,侧重于基础知识的考查,注意对基础知识的学习和积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列叙述正确的是( )
| A. | 聚乙烯、聚氯乙烯、纤维素都属于合成高分子 | |
| B. | 油脂、淀粉和蛋白质都是食物中含有的重要营养物质,一定条件下都能水解 | |
| C. | 除去乙酸乙酯中的少量乙酸,可加入氢氧化钠溶液充分反应后分液 | |
| D. | 丙烷的同分异构体共有3种 |
7.下列有关物质组成的说法正确的是( )
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 纯净的硫酸是纯净物,而不含杂质的盐酸是混合物 | |
| D. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 |
4.Na2CO3的摩尔质量为106g•mol-1.将5.3gNa2CO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Na+的物质的量浓度为( )
| A. | 5.0mol•L-1 | B. | 0.10mol•L-1 | C. | 1.0mol•L-1 | D. | 0.50mol•L-1 |
11.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
1.聚碳酸酯 的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯  与哪类物质缩合聚合而成( )
与哪类物质缩合聚合而成( )
 的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯  与哪类物质缩合聚合而成( )
与哪类物质缩合聚合而成( )| A. | 二卤代物 | B. | 二酚类 | C. | 二醛类 | D. | 二烯类 |
8.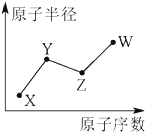 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
19.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:
在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.