题目内容
19.下列说法中正确的是( )| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
分析 A.生成氢气的速率与氢离子浓度有关,pH相同两溶液中氢离子浓度相等;
B.两溶液中氢离子浓度不同,则生成氢气的速率不相等;
C.醋酸为弱酸,醋酸的浓度大于盐酸,锌足量时醋酸生成氢气的质量较大;
D.硫酸为二元酸,等浓度、等体积的两溶液中,硫酸含有氢离子的物质的量较大.
解答 解:A.生成氢气的速率与氢离子浓度大小有关,100 mL pH=3的盐酸和醋酸溶液中氢离子浓度相等,与足量锌反应时,起始时二者产生氢气的速率基本相等,故A正确;
B.100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,前者氢离子浓度大于后者,则前者反应速率较大,两溶液中生成氢气的速率不相等,故B错误;
C.100 mL pH=3的盐酸和醋酸溶液与足量锌反应后,由于醋酸浓度大于盐酸,则醋酸溶液与锌反应生成氢气的质量较大,故C错误;
D.100mL 0.1mol•L-1的硫酸和盐酸溶液与足量锌反应后,前者氢离子浓度是后者2倍,则放出氢气的质量前者是后者放出氢气质量的2倍,故D错误;
故选A.
点评 本题考查较为综合,涉及弱电解质的电离、金属与酸的反应、溶液酸碱性与溶液pH的关系,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握化学反应速率的影响因素.

练习册系列答案
相关题目
10.在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C (s)+H2O(g)?CO(g)+H2(g)下列叙述中可以认定上述可逆反应已达到化学平衡状态的是( )
| A. | 容器内压强不再发生变化 | |
| B. | v正(CO)=v正(H2O) | |
| C. | 生成n mol CO的同时,消耗n mol H2O | |
| D. | 1 mol H-H键断裂的同时,形成2 mol H-O键 |
7.下列有关物质组成的说法正确的是( )
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 纯净的硫酸是纯净物,而不含杂质的盐酸是混合物 | |
| D. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 |
4.Na2CO3的摩尔质量为106g•mol-1.将5.3gNa2CO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Na+的物质的量浓度为( )
| A. | 5.0mol•L-1 | B. | 0.10mol•L-1 | C. | 1.0mol•L-1 | D. | 0.50mol•L-1 |
11.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
8.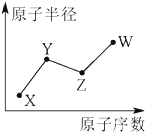 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y是形成化合物种类最多的元素,Z与X可形成两种常温下液态的化合物,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W三种元素只可能形成3种化合物 | |
| B. | X、Y、Z三种元素可形成的化合物超过8种 | |
| C. | Y、W的含氧酸的酸性:Y<W | |
| D. | 1molX、Y两种元素形成的化合物充分燃烧,消耗氧气就是2mol |
2.有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:(1)1molX与足量的金属钠反应产生1.5mol气体 (2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物 (3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是( )
根据上述信息,对X的结构判断正确的是( )
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
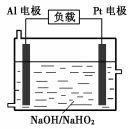 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下: