题目内容
1.热化学方程式:S(g)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,分析下列说法中正确的是( )| A. | S(g)+O2(g)═SO2(l)|△H|<297.3 kJ•mol-1 | |
| B. | 1molSO2的键能总和大于1molS和1molO2键能之和 | |
| C. | S(s)+O2(g)═SO2(g)|△H|>297.3 kJ•mol-1 | |
| D. | 1molSO2的键能总和小于1molS和1molO2键能之和 |
分析 A.物质由气态转变成液态也要放出热量,则该反应放出热量增大;
B.放热反应中,反应物中旧键断裂吸收的能量小于生成物中新键形成所放出的能量;
C.物质由固态转变成液态要吸收热量,则该反应放出热量减小;
D.放热反应中反应物中旧键断裂吸收的能量小于生成物中新键形成所放出的能量.
解答 解:A.物质由气态转变成液态也要放出热量,所以S(g)+O2(g)=SO2(l)的反应热的数值大于297.23kJ•mol-1,故A错误;
B.放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故B正确;
C.物质由固态转变成液态要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的数值小于297.23kJ•mol-1,故C错误;
D.根据B可知,1molSO2的键能总和大于1molS和1molO2的键能总和,故D错误;
故选B.
点评 本题考查热化学方程式,题目难度不大,明确化学反应与能量变化的关系为解答关键,注意掌握物质不同状态与具有能量的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | HClO的电子式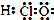 | |
| B. | 比例模型 :可以表示CH4,也可以表示CCl4 :可以表示CH4,也可以表示CCl4 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 碳酸氢根电离:HCO3-?H++CO32- |
13.标准状况下的H2S气体4.48L通入100mL 5mol/L的CuSO4溶液中,再向混合溶液中滴加2mol/L NaOH溶液,当溶液的pH=7时,滴入的NaOH溶液体积为( )
| A. | 200mL | B. | 500 mL | C. | 250 mL | D. | 100 mL |
10.可逆反应2NO2(g)?2NO(g)+O2(g)在恒容密闭容器中进行,可以作为达到平衡状态的标志是( )
| A. | NO2的反应速率与NO的反应速率相等 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 单位时间内生成n molO2的同时生成2nmolNO |
1.某加工食品说明书有如图营养成分表
①表中的微量元素碘,柠檬味酸是食品添加剂,其pH小于 7(选填“大于”、“等于”或“小于”).
②维生素C广泛存在于蔬菜水果中,受热容易分解,因此蔬菜水果的最佳食用方式是生食;
③欲检验样品中是否含有淀粉,具体方法是取少量样品滴加几滴碘水,若观察到蓝色则含淀粉.
| 配料 | 水、果汁、白砂糖、食品添加剂 | |||||
| 项目 | 糖类 | 维生素 | 柠檬味酸 | 氯 | 钠 | 碘 |
| 每100g | 42.5g | 200mg | 100mg | 50mg | 90mg | 3.5mg |
②维生素C广泛存在于蔬菜水果中,受热容易分解,因此蔬菜水果的最佳食用方式是生食;
③欲检验样品中是否含有淀粉,具体方法是取少量样品滴加几滴碘水,若观察到蓝色则含淀粉.

 ,符合上述条件的R分子核磁共振氢谱有5组峰.
,符合上述条件的R分子核磁共振氢谱有5组峰. ;
; .反应②的反应类型缩聚反应.请设计合理方案,完成从
.反应②的反应类型缩聚反应.请设计合理方案,完成从 到
到  的合成路线(用合成路线流程图表示,并注明反应条件):
的合成路线(用合成路线流程图表示,并注明反应条件): .
.

 .
.