题目内容
11.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )| A. | HClO的电子式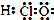 | |
| B. | 比例模型 :可以表示CH4,也可以表示CCl4 :可以表示CH4,也可以表示CCl4 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 碳酸氢根电离:HCO3-?H++CO32- |
分析 A.次氯酸的中心原子为O原子,分子中不存在H-Cl键;
B.四氯化碳分子中,氯原子的原子半径大于C原子;
C.乙烯的结构简式中没有标出碳碳双键;
D.碳酸氢根离子在溶液中部分电离出碳酸根离子和氢离子.
解答 解:A.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为 ,故A错误;
,故A错误;
B.比例模型 可以表示CH4,但是不能表示CCl4,因为四氯化碳中C原子的相对体积小于Cl原子,故B错误;
可以表示CH4,但是不能表示CCl4,因为四氯化碳中C原子的相对体积小于Cl原子,故B错误;
C.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故C错误;
D.碳酸氢根离子只能部分电离,存在电离平衡,其电离方程式为:HCO3-?H++CO32-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、比例模型、结构简式、电离方程式等知识,明确常见化学用语的概念及书写原则为解答结构,试题有利于培养学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法合理的是( )
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 | |
| D. | 若X+和Y2-的核外电子层结构相同,则原子序数:Y<X |
2.0.6mol锌粉跟过量盐酸反应,在一定温度下,为加快反应速率但又不影响生成氢气的总量,可向反应混合物中加入适量的( )
| A. | 铜粉 | B. | 醋酸锌溶液 | C. | 氯化铜固体 | D. | 二氧化锰 |
19.下列各项中表达正确的是( )
| A. | 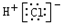 | |
| B. | NH4Br的电子式: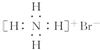 | |
| C. | N2的结构式: | |
| D. | 原子核内有18个中子的氯原子:3517Cl |
6.如图是元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

| A. | 常压下五种元素的单质中Z单质的沸点最高 | |
| B. | X元素形成的气态氢化物比W形成的气态氢化物稳定 | |
| C. | 氯离子的还原性比Y2-元素的简单阴离子的还原性强 | |
| D. | Y元素的非金属性比W元素的非金属性弱 |
16.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列制备环氧乙烷的反应中,符合“绿色化学”理念的是( )
| A. | CH2═CH2+CH3COOOH(过氧乙酸)→ +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Cl2+Ca(OH)2→ +CaCl2+H2O +CaCl2+H2O | |
| C. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$2 | |
| D. | 3CH2OHCH2OH$\stackrel{催化剂}{→}$HOCH2CH2-O-CH2CH2OH+ +2H2O +2H2O |
1.热化学方程式:S(g)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,分析下列说法中正确的是( )
| A. | S(g)+O2(g)═SO2(l)|△H|<297.3 kJ•mol-1 | |
| B. | 1molSO2的键能总和大于1molS和1molO2键能之和 | |
| C. | S(s)+O2(g)═SO2(g)|△H|>297.3 kJ•mol-1 | |
| D. | 1molSO2的键能总和小于1molS和1molO2键能之和 |
 ;
; .
.