题目内容
10.可逆反应2NO2(g)?2NO(g)+O2(g)在恒容密闭容器中进行,可以作为达到平衡状态的标志是( )| A. | NO2的反应速率与NO的反应速率相等 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 单位时间内生成n molO2的同时生成2nmolNO |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、只要反应发生,就有NO2的反应速率与NO的反应速率相等,故A错误;
B、混合气体的颜色不再改变,即二氧化氮的浓度不变,说明达平衡状态,故B正确;
C、恒容的闭容器中混合气体的密度一直不改变,故C错误;
D、单位时间内生成n molO2的同时生成2nmolNO,都体现正反应方向,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
1.热化学方程式:S(g)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,分析下列说法中正确的是( )
| A. | S(g)+O2(g)═SO2(l)|△H|<297.3 kJ•mol-1 | |
| B. | 1molSO2的键能总和大于1molS和1molO2键能之和 | |
| C. | S(s)+O2(g)═SO2(g)|△H|>297.3 kJ•mol-1 | |
| D. | 1molSO2的键能总和小于1molS和1molO2键能之和 |
18.标准状况下 1.68L 无色可燃气体在足量氧气中完全燃烧.若将产物全部通入足量澄清石灰水,得到的白色沉淀 15.0g;若用足量碱石灰吸收所有燃烧产物,装碱石灰的干燥管增重 9.3g.若该气体由两种等物质的量的气体组成.则该气体的成分可能是( )
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
5.下列有关说法不正确的是( )
| A. | 某反应的△H>0、△S<0,则该反应一定不能正向自发进行 | |
| B. | 用简易量热计测定反应热时,需用环形玻璃搅拌棒搅拌使酸和碱充分反应 | |
| C. | 化合反应一定是放热反应,分解反应不一定是吸热反应 | |
| D. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 |
15.下列说法正确的是( )
| A. | 天然橡胶分子中含有碳碳双键,能发生加成反应 | |
| B. | 硫化橡胶遇汽油能发生溶胀现象 | |
| C. | 聚硫橡胶具有良好的耐严寒,耐高温性能 | |
| D. | 合成橡胶是以石油、天然气为原料,以二烯烃和烯烃为单体聚合而成分高分子 |
9.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
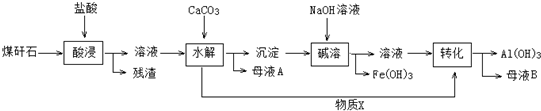
已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
10. 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
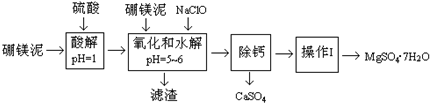
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
(5)硫酸镁分解生成的SO2经如图的两个循环可分别得到S和H2SO4.写出循环Ⅰ中反应2的化学方程式为4ZnFeO3.5+SO2$\frac{\underline{\;△\;}}{\;}$4ZnFeO4+S;循环Ⅱ中电解过程阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |