题目内容
13.标准状况下的H2S气体4.48L通入100mL 5mol/L的CuSO4溶液中,再向混合溶液中滴加2mol/L NaOH溶液,当溶液的pH=7时,滴入的NaOH溶液体积为( )| A. | 200mL | B. | 500 mL | C. | 250 mL | D. | 100 mL |
分析 硫化氢的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,硫酸铜的物质的量为:0.1L×5mol/L=0.5mol;
将0.2H2S气体通入含有0.5molCuSO4溶液中,发生反应H2S+CuSO4=CuS↓+H2SO4,显然硫化氢不足,再向混合溶液中滴加NaOH溶液,当溶液的pH=7时,溶液中溶质为Na2SO4,根据硫酸根守恒计算Na2SO4,根据钠离子守恒计算NaOH物质的量,进而计算NaOH溶液体积.
解答 解:将标准状况下4.48L的H2S气体通入的CuSO4溶液中,发生反应:H2S+CuSO4=CuS↓+H2SO4,硫化氢的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,硫酸铜的物质的量为:0.1L×5mol/L=0.5mol,显然硫化氢不足,
再向混合溶液中滴加NaOH溶液,剩余的硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,当溶液的pH=7时,溶液中溶质为Na2SO4,
根据硫酸根守恒n(Na2SO4)=n(CuSO4)=0.1L×5mol/L=0.5mol,根据钠离子守恒n(NaOH)=2n(Na2SO4)=1mol,
所以NaOH溶液体积为:$\frac{1mol}{2mol/L}$=0.5L=500mL,
故选B.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
1.热化学方程式:S(g)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,分析下列说法中正确的是( )
| A. | S(g)+O2(g)═SO2(l)|△H|<297.3 kJ•mol-1 | |
| B. | 1molSO2的键能总和大于1molS和1molO2键能之和 | |
| C. | S(s)+O2(g)═SO2(g)|△H|>297.3 kJ•mol-1 | |
| D. | 1molSO2的键能总和小于1molS和1molO2键能之和 |
8.X和Y两种元素可以形成XY2型共价化合物,则X和Y的原子序数为( )
| A. | 3和17 | B. | 6和8 | C. | 12和9 | D. | 8和16 |
18.标准状况下 1.68L 无色可燃气体在足量氧气中完全燃烧.若将产物全部通入足量澄清石灰水,得到的白色沉淀 15.0g;若用足量碱石灰吸收所有燃烧产物,装碱石灰的干燥管增重 9.3g.若该气体由两种等物质的量的气体组成.则该气体的成分可能是( )
| A. | C3H4和 H2 | B. | C3H8和 CO | C. | CH4和 C3H4 | D. | C3H6和 CO2 |
5.下列有关说法不正确的是( )
| A. | 某反应的△H>0、△S<0,则该反应一定不能正向自发进行 | |
| B. | 用简易量热计测定反应热时,需用环形玻璃搅拌棒搅拌使酸和碱充分反应 | |
| C. | 化合反应一定是放热反应,分解反应不一定是吸热反应 | |
| D. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 |
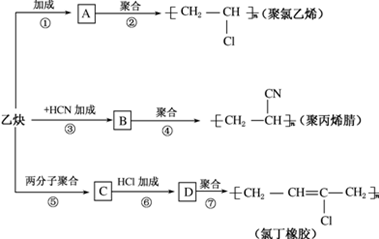
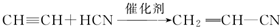 ;
;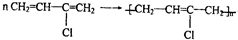 .
. 、
、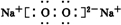 .
.