题目内容
16.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1: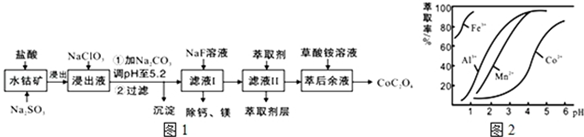
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴.
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水;
(3)滤液Ⅱ中加入萃取剂的作用是除去锰离子;根据图知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(4)当加入过量NaF后,所得滤液$\frac{C(M{g}^{2+})}{C(C{a}^{2+})}$=$\frac{\frac{{K}_{sp}(Mg{F}_{2})}{{C}^{2}({F}^{-})}}{\frac{{K}_{sp}(Ca{F}_{2})}{{C}^{2}({F}^{-})}}$=$\frac{{K}_{SP}(Mg{F}_{2})}{{K}_{sp}(Ca{F}_{2})}$代入相关数据即可求解.
解答 解:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴.
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,
故答案为:Fe3+、Co3+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(4)当加入过量NaF后,所得滤液$\frac{C(M{g}^{2+})}{C(C{a}^{2+})}$=$\frac{\frac{{K}_{sp}(Mg{F}_{2})}{{C}^{2}({F}^{-})}}{\frac{{K}_{sp}(Ca{F}_{2})}{{C}^{2}({F}^{-})}}$=$\frac{{K}_{SP}(Mg{F}_{2})}{{K}_{sp}(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7.
故答案为:0.7.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.

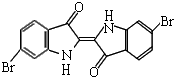 泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )
泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )| A. | 泰雅紫分子的分子式为C16H8N2Br2O2 | |
| B. | 1mol泰雅紫与H2加成最多需9molH2 | |
| C. | 泰雅紫属于烃的衍生物 | |
| D. | 检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成 |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将SO2通入Ba(NO3)2溶液中,溶液变浑浊 | 生成BaSO3沉淀 |
| B | 点燃CO还原Fe2O3后的尾气,气体未能燃烧 | CO已完全反应 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 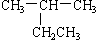 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 4-丁醇 | ||
| C. | 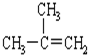 2-甲基-2-丙烯 2-甲基-2-丙烯 | D. | 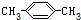 对二甲苯 对二甲苯 |
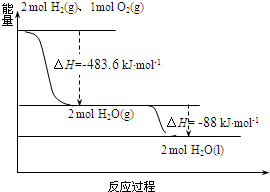
| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
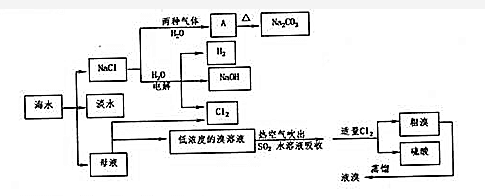
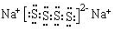 .
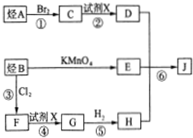
.
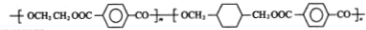
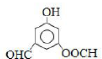 .
.