题目内容
6.依据图判断,下列说法正确的是( )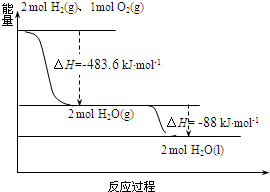
| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
分析 A、氢气与氧气反应放热,反应物能量高于生成物;
B、氢气燃烧的反应为放热反应,但H2与O2的反应需要外界条件引发反应,常温混合不能自发进行;
C、根据图象2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故逆反应为吸热反应;
D、H2O(g)生成H2O(l)时为放热反应,故断键吸收的能量小于成键放出的能量.
解答 解:A、氢气与氧气反应放热,反应物能量高于生成物,所以2 molH2(g)和1molO2(g)的总能量大于2molH2O(g)的能量,故A正确;
B、氢气燃烧的反应为放热反应,但H2与O2的反应需要外界条件引发反应,常温混合不能自发进行,故B错误;
C、根据图象2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故逆反应为吸热反应,2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1,故C错误;
D、H2O(g)生成H2O(l)时为放热过程,没有发生化学变化,故D错误.
故选A.
点评 本题考查了焓变、盖斯定律、焓变与反应物生成物能量的关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
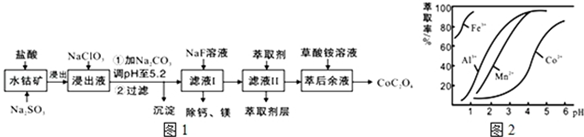
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
14.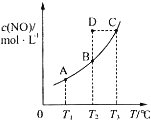 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)?CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
1.氮化钛(Ti3N4)为金黄色晶体,是市售仿金品的重要成份.以TiCl4为原料,经过一系列反应(见图1)可以制得Ti3N4和纳米TiO2.
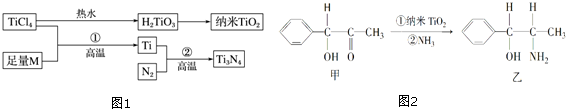
①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
M是Mg (填元素符号),该金属晶体的堆积模型为A3型最密堆积又称六方最密堆积.
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.

①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
15.合成具有美白作用的化妆品原料Z的反应原理如下:
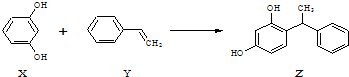
下列叙述不正确的是( )

下列叙述不正确的是( )
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |

 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应. .
.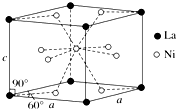 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
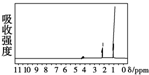
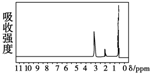
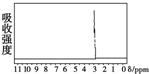
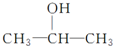 的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )
的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )