题目内容
5.某种新型材料J的合成路线如图所示: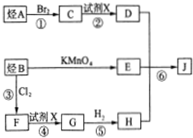
J的结构简式为:
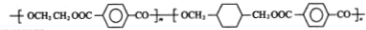
(1)物质C的名称是1,2-二溴乙烷,物质H中所含官能团为羟基,物质B分子中最多有14个原子共平面;反应⑥的反应类型是缩聚反应.
(2)假设各步反应均完全进行,则合成J所需烃A与烃B的物质的量之比为1:3.
(3)写出反应②的化学方程式并注明反应条件:CH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr.
(4)同时符合下列3个要求的E的同分异构体共有10种,这些同分异构体在核磁共振氢谱中出现的各组峰的面积之比均为1:1:1:1:1:1,等质量的这些同分异构体在于浓溴水发生取代反应,消耗溴的物质的量最多的同分异构体的结构简式为
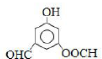 .
.①遇到FeCl3溶液显紫色
②能够发生水解反应
③能够发生银镜反应,且其余生成的Ag物质的量之比为1:4.
分析 由J的结构简式为: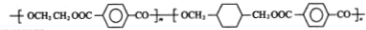 可知,D、E、H为J的单体,所以它们为HOCH2CH2OH、
可知,D、E、H为J的单体,所以它们为HOCH2CH2OH、 、
、 中的一种,根据各物质的转化关系,烃A应为CH2=CH2,A与溴发生加成反应生成C为CH2BrCH2Br,C碱性水解得D为HOCH2CH2OH,B应为对二甲苯,B被高锰酸钾氧化生成E为
中的一种,根据各物质的转化关系,烃A应为CH2=CH2,A与溴发生加成反应生成C为CH2BrCH2Br,C碱性水解得D为HOCH2CH2OH,B应为对二甲苯,B被高锰酸钾氧化生成E为 ,B与氯气在光照条件下发生取代生成F为
,B与氯气在光照条件下发生取代生成F为 ,F发生碱性水解得G为
,F发生碱性水解得G为 ,G与氢气发生加成反应生成H为
,G与氢气发生加成反应生成H为 ,据此答题;
,据此答题;
解答 解:由J的结构简式为: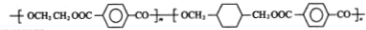 可知,D、E、H为J的单体,所以它们为HOCH2CH2OH、
可知,D、E、H为J的单体,所以它们为HOCH2CH2OH、 、
、 中的一种,根据各物质的转化关系,烃A应为CH2=CH2,A与溴发生加成反应生成C为CH2BrCH2Br,C碱性水解得D为HOCH2CH2OH,B应为对二甲苯,B被高锰酸钾氧化生成E为
中的一种,根据各物质的转化关系,烃A应为CH2=CH2,A与溴发生加成反应生成C为CH2BrCH2Br,C碱性水解得D为HOCH2CH2OH,B应为对二甲苯,B被高锰酸钾氧化生成E为 ,B与氯气在光照条件下发生取代生成F为
,B与氯气在光照条件下发生取代生成F为 ,F发生碱性水解得G为
,F发生碱性水解得G为 ,G与氢气发生加成反应生成H为
,G与氢气发生加成反应生成H为 ,
,
(1)C为CH2BrCH2Br,物质C的名称是1,2-二溴乙烷,H为 ,H中所含官能团为羟基,B应为对二甲苯,B分子中最多有14个原子共平面,反应⑥的反应类型是缩聚反应,
,H中所含官能团为羟基,B应为对二甲苯,B分子中最多有14个原子共平面,反应⑥的反应类型是缩聚反应,
故答案为:1,2-二溴乙烷;羟基;14;缩聚反应;
(2)根据J的结构简式可知,假设各步反应均完全进行,则合成J所需烃A与烃B的物质的量之比为1:3,
故答案为:1:3;
(3)反应②为CH2BrCH2Br的碱性水解,反应的化学方程式为CH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,
故答案为:CH2BrCH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;
(4)E为 ,根据条件:①遇到FeCl3溶液显紫色,说明有酚羟基,②能够发生水解反应,说明有酯基,③能够发生银镜反应,且其生成的Ag物质的量之比为1:4,说明有两个醛基,则符合要求的E的同分异构体为苯环上连有-OH、-CHO、-OOCH三个基团,共有10种,这些同分异构体在核磁共振氢谱中出现的各组峰的面积之比均为1:1:1:1:1:1,等质量的这些同分异构体在于浓溴水发生取代反应,消耗溴的物质的量最多的同分异构体的结构简式为
,根据条件:①遇到FeCl3溶液显紫色,说明有酚羟基,②能够发生水解反应,说明有酯基,③能够发生银镜反应,且其生成的Ag物质的量之比为1:4,说明有两个醛基,则符合要求的E的同分异构体为苯环上连有-OH、-CHO、-OOCH三个基团,共有10种,这些同分异构体在核磁共振氢谱中出现的各组峰的面积之比均为1:1:1:1:1:1,等质量的这些同分异构体在于浓溴水发生取代反应,消耗溴的物质的量最多的同分异构体的结构简式为 ,
,
故答案为:10;1:1:1:1:1:1; .
.
点评 本题考查有机物的推断,侧重于学生分析能力和推断能力的考查,该题信息量大,注意根据高聚物的结构简式判断单体为解答该题的突破口,答题时注意把握题给信息,为解答该题的关键,题目难度中等

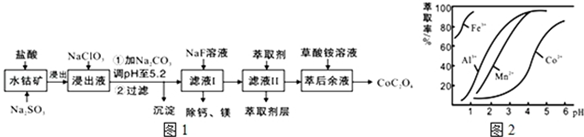
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
| A. | 向该溶液中加入过量NaOH溶液,仍能大量存在:ClO-、K+、CO32-、Cl- | |
| B. | 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | 向该溶液中加入过量Ba(OH)2溶液,有白色沉淀生成2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 将该溶液蒸干、灼烧得到是K 2SO4和Al2O3 |
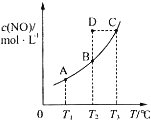 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
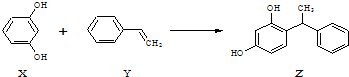
下列叙述不正确的是( )
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |

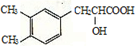 +NaHCO3
+NaHCO3
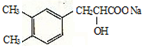 +CO2↑+H2O.
+CO2↑+H2O.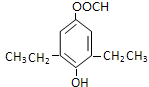 或
或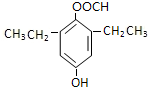 .
.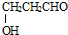 ,请写出以
,请写出以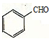 、CH3CH2OH为原料合成
、CH3CH2OH为原料合成 的路线流程图(无机试剂可任选).合成路线流程图如下:
的路线流程图(无机试剂可任选).合成路线流程图如下: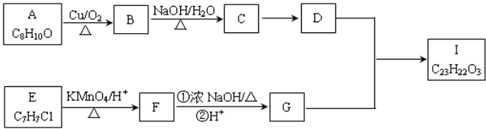
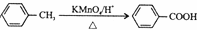
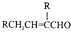
 .
. .
. .
.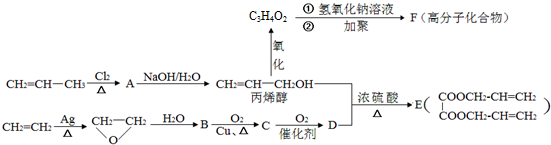
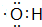 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应.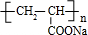 .
.