题目内容
17.下列实验操作能达到实验目的是( )| 实验目的 | 实验内容 | |
| A | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中,再加水稀释 |
| B | 探究温度对硫代硫酸钠与硫酸反应速率的影响 | 先将两种溶液混合并计时,再用水浴加热至设定温度 |
| C | 证明Ksp(BaSO4)<Ksp(CaSO4) | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. |
| D | HSO3-结合H+的能力比SO32-强 | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先将氯化铁溶解在盐酸中,可防止水解;
B.应先加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合;
C.向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀,不能确定生成的沉淀成分;
D.阴离子水解程度越大,溶液pH越大,说明越易结合氢离子.
解答 解:A.氯化铁是强酸弱碱盐所以在水溶液中能水解,为抑制氯化铁水解,应向氯化铁溶液中加盐酸,所以配制氯化铁溶液时,将一定量氯化铁固体溶解在较浓的盐酸中,再用水稀释到所需浓度,该实验操作能达到实验目的,故A正确;
B.该实验要求开始时温度相同,然后改变温度,探究温度对反应速率的影响,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,若是先将两种溶液混合后再用水浴加热,随着热量的散失,测得的反应速率偏低,故B错误;
C.向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀,无法确定生成沉淀成分,则不能比较溶度积大小,故C错误;
D.阴离子水解程度越大,溶液pH越大,说明越易结合氢离子,则HSO3-结合H+的能力比SO32-的弱,故D错误;
故选A.
点评 本题考查实验方案的评价,题目难度中等,涉及物质的性质比较,检验,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,试题有利于提高学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
7.反应4A(g)+3B(g)?2C(g)+D(g),达到平衡时,下列说法正确的是( )
| A. | A、B全部变成了C和D | B. | B的正反应速率和逆反应速率相等 | ||
| C. | 反应已经停止 | D. | A、B、C、D四种物质的浓度一定相等 |
8.下列说法不正确的是( )
| A. | 研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系 | |
| B. | 能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平 | |
| C. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ |
5.下列物质晶体中,同时存在非极性键、极性键和氢键的是( )
| A. | CaC2 | B. | H2O | C. | C2H4 | D. | H2O2 |
9.海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的.
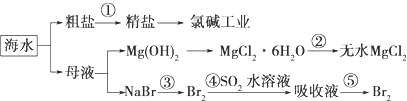
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液-→过滤后加盐酸 | |
| B. | 从第③步到第⑤步的目的是浓缩、富集溴 | |
| C. | 第①到第⑤步中,涉及到氧化还原反应共有2步 | |
| D. | 第④步中,SO2起氧化作用 |
19.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32克O2和O3组成的混合气体中含有的氧原子数目为2NA | |
| B. | 常温常压下,22.4 L乙醇含有的分子数目为NA | |
| C. | 1 mol Na变为Na+时得到的电子数目为NA | |
| D. | 44克14C16O2含氧原子数为2NA |

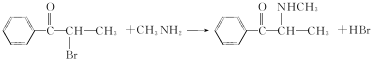 .A→B的反应类型为取代反应.
.A→B的反应类型为取代反应.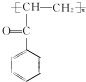 .
.
 的合成路线:
的合成路线: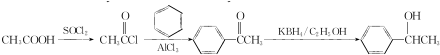 .
.