题目内容
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 某澄清透明溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 含0.1mol•L-1 Ba2+的溶液中:Na+、K+、SO42-、Cl- | |
| C. | 含0.1mol•L-1 CO32-的溶液中:OH-、Cl-、NH4+、Na+ | |
| D. | 加入铝粉产生H2的溶液中:Al3+、Na+、SO42-、NO3- |
分析 A.四种离子之间不发生反应,为澄清透明溶液;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.氢氧根离子与铵根离子反应;
D.加入铝粉产生H2的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应.
解答 解:A.K+、Fe3+、NO3-、Cl-之间不发生反应,为澄清透明溶液,在溶液中能够大量共存,故A正确;
B.Ba2+、SO42-之间反应生成硫酸钡,在溶液中不能大量共存,故B错误;
C.OH-、NH4+之间反应生成弱电解质一水合氨,在溶液中不能大量共存,故C错误;
D.加入铝粉产生H2的溶液呈酸性或碱性,Al3+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
15.学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
找出上述三组分类中的错误,错误物质的化学式为Na2CO3、Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
该变化的基本反应类型是分解反应,Q物质的作用为催化剂.
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO3 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
16.“天宫一号”使用镍氢电池供电.镍氢电池的负极材料为储氢合金(用-表示,氢以单原子填入合金晶格),总反应为M+Ni(OH)2$?_{放电}^{充电}$MH+NiOOH,下列说法正确的是( )
| A. | 电池充电时氢原子被氧化 | |
| B. | 电池放电时正极为NiOOH | |
| C. | 电池充电时,与电源负极相连的电极反应为:MH+OH--e-═M+H2O | |
| D. | 电池放电时,负极反应为:Ni(OH)2+OH--e-=NiOOH+H2O |
13.下列反应中转移电子的物质的量不等于2mol的是( )
| A. | 1 mol Al与含1mol H2SO4的稀硫酸溶液反应 | |
| B. | 1mol Cu与含4mol HNO3的浓硝酸溶液反应 | |
| C. | 1 mol Cu与含2 mol H2SO4的浓硫酸共热 | |
| D. | 1 mol MnO2与足量浓盐酸共热 |
10.我国湘黔渝三地交界地区是中国电解锰企业最集中的地区,被称为中国的“锰三角”.金属锰的熔点很高,常用铝热法制得粗锰,再用电解法制得纯的金属锰.铝被用于冶炼金属锰,是因为铝( )
| A. | 熔点低 | B. | 具有还原性 | ||
| C. | 具有两性 | D. | 冶炼反应中放出大量的热 |
17.除去FeCl3溶液中混有的少量FeCl2,可以向此溶液中通入过量的氯气,发生如下反应:2FeCl2+Cl2═2FeCl3.对于该反应说法正确的是( )
| A. | 属于氧化还原反应 | B. | 属于复分解反应 | ||
| C. | Cl2作还原剂 | D. | Fe2+被还原 |
15.短周期主族元素W、X、Y、Z的原子序数依次递增.其中W、X的简单离子具有相同的电子层结构,且简单离子所带电荷绝对值相同;W与Y同主族.且Y的单质存在于火山口附近.下列说法正确的是( )
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
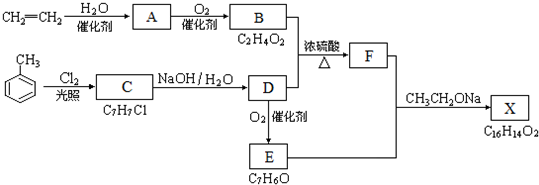
 ;
; ;
;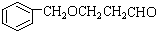 B、
B、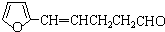
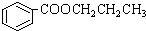
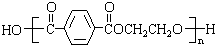 ,其合成单体为
,其合成单体为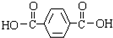 和HOCH2CH2OH;
和HOCH2CH2OH;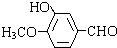 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.