题目内容
10.科学家已发现一种新型氢分子H4,在相同条件下,等质量的H2和H4具有相同的( )| A. | 原子数 | B. | 分子数 | C. | 体积 | D. | 物质的量 |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合分子的构成计算.
解答 解:M(H4)≠M(H2),由n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$可知,等质量的H4和H2的物质的量、体积以及分子数不同,二者都由H原子构成,等质量的H4和H2含有的H原子质量相同,则H原子个数相同,
故选A.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握物质的构成特点.

练习册系列答案
相关题目
20.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
1.有一根粗铝含铁和硅两种杂质,取等质量的粗铝分别投入足量稀HCl和足量的NaOH液中,放出等量的H2,则该粗铝中,铁和硅的关系为( )
a.物质的量之比为2:1;b.物质的量之比为3:1; c.质量之比为2:1;d.质量之比为4:1.
a.物质的量之比为2:1;b.物质的量之比为3:1; c.质量之比为2:1;d.质量之比为4:1.
| A. | bd | B. | bc | C. | ad | D. | 只有d |
5.向一盛有氯气的集气瓶中加入某液体,振荡后,形成无色溶液,则加入的液体是( )
| A. | 水 | B. | 碘化钾溶液 | C. | 氯化亚铁溶液 | D. | 氢氧化钠溶液 |
2.某校化学小组学生利用下图所示装置进行“乙二酸(结构简式为HOOC-COOH,俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
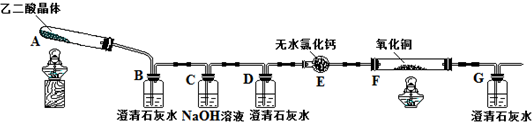
(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式:c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
20.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.