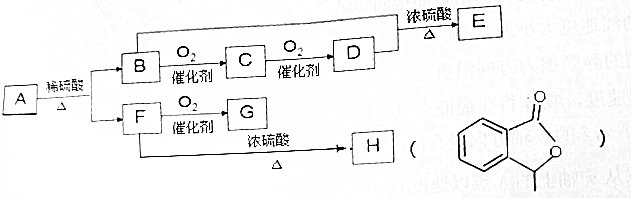
题目内容
19.现有常见金属A、B,它们之间存在如下的转化关系(图中有些反应的产物和反应的条件没有全部标出),其中G、H为白色沉淀.请回答下列问题: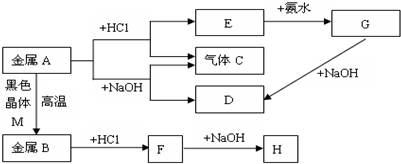
(1)写出金属A和物质D的名称或化学式:Al、NaAlO2.
(2)写出E转化为G的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)写出H放在空气中的现象:白色沉淀迅速变为灰绿色再转化为红褐色.
(4)写出H放在空气中的化学方程式:4Fe(OH)2+O2+2H2O═Fe(OH)3.
分析 金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,E为AlCl3,D为NaAl2,G为Al(OH)3,金属A与黑色晶体M在高温下反应得到金属B,可推知M为Fe3O4,B为Fe,与盐酸反应得到F,F能与NaOH反应,可推知F为FeCl2,由问题(3)可知H为Fe(OH)2,据此解答.
解答 解:金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,E为AlCl3,D为NaAl2,G为Al(OH)3,金属A与黑色晶体M在高温下反应得到金属B,可推知M为Fe3O4,B为Fe,与盐酸反应得到F,F能与NaOH反应,可推知F为FeCl2.
(1)由上述分析可知,金属A为Al,物质D为NaAlO2,故答案为:Al;NaAlO2;
(2)E转化为G的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)H为Fe(OH)2,暴露在空气中被氧化生成氢氧化铁,现象为:白色沉淀迅速变为灰绿色再转化为红褐色,
故答案为:白色沉淀迅速变为灰绿色再转化为红褐色;
(4)H放在空气中的化学方程式:4Fe(OH)2+O2+2H2O═Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O═Fe(OH)3.
点评 本题考查无机物推断,“A能与酸、碱反应及与黑色晶体M反应得到金属B”是推断的突破口,再结合转化关系推断,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
相关题目
9.1.52g铜镁合金完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是1:2 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
10.科学家已发现一种新型氢分子H4,在相同条件下,等质量的H2和H4具有相同的( )
| A. | 原子数 | B. | 分子数 | C. | 体积 | D. | 物质的量 |
7.在一定条件下,当64g SO2气体被氧化成SO3气体时,共放出热量98.3kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ/mol | |
| B. | 2SO2(g)+O2(g)?SO3(l)△H=-196.6 kJ/mol | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-122.9 kJ/mol | |
| D. | 2SO2(g)+O2(g)?SO3(g)△H=+196.6 kJ/mol |
14.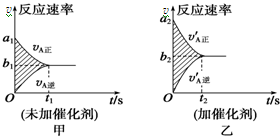 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2
⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积
相等 ⑧图乙中阴影部分面积更大以上所列正确的为 ( )
A.②④⑥⑦B.②④⑤⑧
C.②③⑤⑦D.②③⑥⑧
 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2
⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积
相等 ⑧图乙中阴影部分面积更大以上所列正确的为 ( )
A.②④⑥⑦B.②④⑤⑧
C.②③⑤⑦D.②③⑥⑧
| A. | ②④⑥⑦ | B. | ②④⑤⑧ | C. | ②③⑤⑦ | D. | ②③⑥⑧ |
4.下列除杂试剂、主要操作或方法均正确的是(括号内为杂质)( )
| 选项 | 原物质及杂质 | 除杂试剂 | 主要操作或方法 |
| A | 乙酸乙酯(乙酸) | Na2CO3 | 过滤 |
| B | Na2CO3(s )[NaHCO3(s )] | NaOH溶液 | 转化法 |
| C | FeCl2(CuCl2) | Zn | 过滤 |
| D | 苯(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
8.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
9.把Na2O2投入FeCl2溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀 | C. | 无气泡产生 | D. | 无变化 |