题目内容
4.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构.下列说法中正确的是( )| A. | 原子序数:A<B<C | B. | 原子半径:A>B>C | ||
| C. | 离子半径:A2->C->B2+ | D. | 原子核外最外层电子数:A>C>B |
分析 A、B、C为三种短周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,而电子层结构相同核电荷数越大离子半径越小,据此进行解答.
解答 解:A、B、C为三中短周期元素,结合离子所带电荷可知,A是第ⅥA族,B是第ⅡA族,C位于第ⅦA,B2+与C-具有相同的电子层结构,则B位于C的下一周期,由于A、B同周期,则A、B处于第三周期,C处于第二周期,则A为S、B为Mg、C为F,
A.A为S、B为Mg、C为F,原子序数:S>Mg>F,故A错误;
B.同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:Mg>S>F,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->F->Mg2+,故C正确;
D.A为S、B为Mg、C为F,原子核外最外层电子数:F>S>Mg,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.

练习册系列答案
相关题目
10.下列实验装置或者操作正确的是 ( )

| A. | 排空气法收集氨气 | B. | 制氨水 | ||
| C. | 除二氧化碳中的少量二氧化硫 | D. | 干燥NH3 |
12.下列物质中不能由两种单质直接化合得到的是( )
| A. | FeCl3 | B. | Cu2S | C. | SO3 | D. | NH3 |
19.下列关于有机化合物的说法正确的是( )
| A. |  的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H6Cl2有4种同分异构体 | D. |  分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 |
9.${\;}_{6}^{12}$C、${\;}_{6}^{13}$C和${\;}_{6}^{14}$C,它们之间的关系是( )
| A. | 同系物 | B. | 同位素 | C. | 同分异构体 | D. | 同素异形体 |
16.下列物质属于混合物的是( )
| A. | 过氧化氢 | B. | 氨水 | C. | 水银 | D. | 冰水共存物 |
13.下列反应能用离子方程式OH-+H+=H2O表示的有( )
| A. | 氨水与稀盐酸反应 | B. | H2SO4与Al(OH)3反应 | ||
| C. | 澄清石灰水与稀硝酸反应 | D. | NaOH与CH3COOH溶液反应 |
14.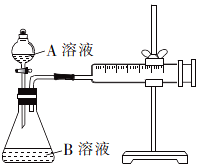 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
(3)若要研究催化剂对化学反应速率的影响,则应对比实验Ⅰ、Ⅱ(填序号,下同);若要研究温度对化学反应速率的影响,则应对比实验Ⅰ、Ⅲ.
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:
高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题: