题目内容
9.由NO与NO2组成的混合气体中氮元素的质量分数为$\frac{35}{91}$,则混合气体中NO与NO2的体积比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 35:56 |
分析 设出一氧化氮和二氧化氮的物质的量,然后根据混合气体中氮元素的质量分数为$\frac{35}{91}$列式计算.
解答 解:设NO与NO2的物质的量分别为x、y,
则:$\frac{14(x+y)}{28x+46y}$×100%=$\frac{35}{91}$,整理可得:x:y=3:2,
相同条件下气体的体积之比等于物质的量之比,则混合气体中NO与NO2的体积比为3:2,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确质量分数的概念及表达式为解答关键,注意掌握物质的量与气体摩尔体积的关系,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.从物质的量浓度为0.075mol•L-1的CaCl2溶液中取出2L溶液,则Cl-为( )
| A. | 9.03×1022 | B. | 0.15mol | C. | 10.65g | D. | 0.075mol•L-1 |
20.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | a+2=b+1=c-3=d-1 | B. | 原子半径:r(A)>r(B)>r(D)>r(C) | ||
| C. | 原子序数:a>b>c>d | D. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) |
17.下列叙述中,不正确的是( )
| A. | 无论在纯水中,还是在稀溶液中,由水电离出的c(H+)与c(OH-)相等 | |
| B. | pH=7的溶液不一定呈中性,c(H+)=c(OH-) 的溶液才是中性溶液 | |
| C. | 无论是酸溶液还是碱溶液中,由水电离出的c(H+)小于纯水电离出的c(H+) | |
| D. | 常温下,在1 mol/L 盐酸中,水的离子积Kw>1×10-14 |
18.下列说法正确的是( )
| A. | 2mol钠与过量盐酸反应生成NA个H2分子 | |
| B. | 少量金属钠加到冷水中,反应的离子方程式是:Na+2H2O═Na++OH-+H2↑ | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 | |
| D. | 为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量 |
19.在下列实验操作中,不能达到目的是( )
| A. | 向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+ | |
| B. | 向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝 | |
| C. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
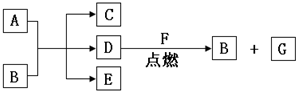
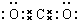 .
. 、丙
、丙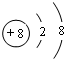 .
.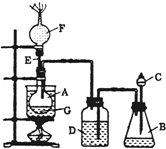 为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题:
为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题: