题目内容
4.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )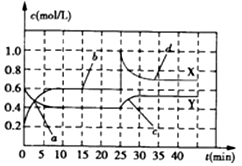
| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
分析 由图可知0-10min平衡状态时,X曲线△c=(0.6-0.2)mol/L=0.4mol/L,Y曲线△c=(0.6-0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)=$\frac{△c}{△t}$;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态.
解答 解:由图可知0-10min平衡状态时,X曲线△c=(0.6-0.2)mol/L=0.4mol/L,Y曲线△c=(0.6-0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),故A错误;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),故B正确;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,故C正确;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选A.
点评 本题考查图象分析及化学平衡计算,为高频考点,侧重考查学生分析、判断及计算能力,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响,明确图象中纵横坐标及点、线、面的意义,题目难度中等.

| A. | 确定过程是否一定会发生 | B. | 判断过程的方向 | ||
| C. | 判断过程发生的速率 | D. | 判断过程的热效应和熵变 |
 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:2Fe+3Br2═2FeBr3,
 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有C6H6、Br2.
②利用温度计控制温度,适宜的温度范围为C(填序号).
A.>156℃B.59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示)Br2+2NaOH=NaBr+NaBrO+H2O;
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是B(填序号).
A.25mL B.50mL C.250mL D.500mL.
| A. | S(g)+O2(g)=SO2(g)△H3S(s)+O2(g)=SO2(g)△H2,则△H1<△H2 | |
| B. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,则反应总能量>生成物总能量 | |
| C. | 己知C(石墨•s)=C(金刚石•s)△H>0,则石墨比金刚石稳定 | |
| D. | 相同条件下,如果1mol氢原子所具有的能量为E1•1mol氢分子所具有的能量为E2,则2E1=E2 |
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
| A. | SO2的转化率为60% | |
| B. | SO3的产率为60% | |
| C. | 平衡时总压强与起始压强之比为7:8 | |
| D. | 平衡时V(SO2):V(O2):V(SO3)=3:3:1 |
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
