��Ŀ����
15���ۺ����ú�ˮ�����Ʊ�ʳ�Ρ��������þ��������ʣ���������ͼ��ʾ��
��1�����ú�ˮ���Ʊ�C12��Ϊ���ڴ��棬�ɽ�C12Һ����Ӧ��ȡ�Ĵ�ʩ֮һ�ǽ��� �����ѹ����
��2�������к��������ơ��Ȼ�þ���Ȼ��Ƶȿ��������ʣ�Ϊ��ȥ��Щ���ʶ��þ��Σ��������²��������ܽ� �ڼӹ�����BaCl2��Һ �ۼӹ�����NaOH��Һ �ܼӹ�����Na2CO3��Һ �ݹ��ˣ���������ƣ���ͬ�� ������������ �������ᾧ��
��3������XΪNH3����Һb�з�����Ӧ�Ļ�ѧ����ʽ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
��4������I���ѻ��Br2����������ֽ�Br2��ԭΪBr-����Ŀ��Ϊ������Ԫ�أ��������ͨ���������Br2����SO2ˮ��Һ�������գ��õ���Һc����Ӧ�����ӷ���ʽΪBr2+SO2+2H2O�T4H++SO42-+2Br-����ʵ�����У��ӹ�ҵ������ȡ�嵥�ʵ�ʵ�������������ȡ��
��5����ҵ����ȡ����þ�Ļ�ѧ����ʽΪMgCl2�����ڣ�$\frac{\underline{\;���\;}}{\;}$Cl2��+Mg��
���� ��1��������Һ�����ɽ����¶Ȼ�ѹǿ��
��2�������ᴿ��ͨ���ܽ�Ѳ�������ʳ�γ������롢���˰Ѳ����ﳹ�׳�ȥ��������ʳ�δ���Һ�з���������õ�ʳ�εĹ��̣�
��3������������ˮ��������̼��ˮ�е��ܽ��С������ʳ��ˮ��ͨ�백������ͨ�������̼��������̼�����ƹ��壬̼���������ȷֽ⼴�ɵõ�̼���ƣ�
��4���������̷�����֪����ˮͨ��һ�����������õ���ˮ��±ˮ��±ˮ������������������������Ϊ�����壬ͨ���ȿ�����ˮ��������Br2�����õ����嵥�ʵ��ӷ��ԣ����������������õ��嵥�ʣ���������ѻ������̬����Ũ�Ⱥܵͣ���������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ���Ǹ�����Ԫ�أ������������ˮ��Һ��Ӧ����������廯�⣬��Ӧ�Ļ�ѧ����ʽΪ��Br2+SO2+2H2O=2HBr+H2SO4���ݴ���д���ӷ���ʽ�������л��ܼ��е��ܽ�ȴ�����ˮ�е��ܽ�ȣ����Կ��Բ�����ȡ�ķ�����ȡ�壻
��5��þΪ���ý��������õ�������Ȼ�þ�ķ�����ȡMg��������
��� �⣺��1�������£�����Ϊ���壬���� �����ѹ����Һ����ת��ΪҺ���������ʹ��棬
�ʴ�Ϊ������ �����ѹ����
��2�������ɵ����ᱵ��̼�ᱵ��̼��ơ�������þ��������Һ�г�ȥ�ù��˵ķ������Ȼ��ƺ�����Ļ����Һ�õ��Ȼ��ƾ��壬�����������ᾧ�ķ�������ȥ��Һ�е��Ȼ����ˮ���ʴ�Ϊ�����ˣ������ᾧ��
��3����ͬ�����£��������ܽ�ȴ��ڶ�����̼��Ϊ����߶�����̼���ܽ�ȣ�����ʳ��ˮ��ͨ�백����������Һb��Ϊ�Ȼ��ƺͰ�ˮ�Ļ��Һ������XΪ������YΪ������̼��NaCl��NH3��CO2�ȷ�����Ӧ����NaHCO3��NH4Cl����ӦΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
�ʴ�Ϊ��NH3��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
��4����������ѻ������̬����Ũ�Ⱥܵͣ����ֱ�����������ɱ��ϸߣ������ڹ�ҵ��������������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ���Ǹ�����Ԫ�أ����ͳɱ����������������嵥�ʷ�����Ӧ������ǿ��HBr��H2SO4�����ӷ�ӦΪ��Br2+SO2+2H2O�T4H++SO42-+2Br-�������л��ܼ��е��ܽ�ȴ�����ˮ�е��ܽ�ȣ����л��ܼ���ˮ�����ܣ����Կ��Բ�����ȡ�ķ�����ȡ�壬
�ʴ�Ϊ��������Ԫ�أ�Br2+SO2+2H2O�T4H++SO42-+2Br-����ȡ��
��5��������״̬�µ���Ȼ�þұ��þ����ⷴӦ����ʽΪ��MgCl2�����ڣ�$\frac{\underline{\;���\;}}{\;}$Cl2��+Mg��
�ʴ�Ϊ��MgCl2�����ڣ�$\frac{\underline{\;���\;}}{\;}$Cl2��+Mg��
���� ���⿼���˺�ˮ��Դ���ۺ����ã����ݻ�ѧ��Ӧ�ĸ������ͼ�����ʵ��������������֪������ͼ��ÿһ���ķ�Ӧ������д��Ӧ�Ļ�ѧ����ʽ��֪����������ij���������������ѧ���ķ���������ʵ��������Ԫ�ػ�����֪ʶ���ۺ���������õĿ��飬����������ѧ�������õĿ�ѧ��������Ŀ�Ѷ��еȣ�

| A�� | HCl | B�� | Fe3+ | C�� | Cl- | D�� | CH3COO- |
| A�� | Cl-�����ʵ���Ũ��Ϊ2mol/L | |
| B�� | CaCl2�����ʵ���Ϊ1mol | |
| C�� | ȡ��50 mL��ʣ����Һ��CaCl2�����ʵ���Ũ��Ϊ0.5mol/L | |
| D�� | ����Һ��ˮ�����Ϊ100 mL |
| A�� | 13��8��27 | B�� | 13��9��27 | C�� | 26��16��27 | D�� | 286��8��27 |
| A�� | �۱�ϩ�Ľṹ��ʽ��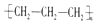 | B�� | ������ӵı���ģ�ͣ� | ||
| C�� | ��Ȳ�ĵ���ʽ�� | D�� | 2-�һ�-1��3-����ϩ���ӵļ���ʽ��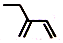 |
| ʵ������ | ʵ��Ŀ�� | |
| A | ��1mL 1%��NaOH��Һ�м���2mL 2%��CuSO4��Һ�����ټ���0.5mL�л���X��������к�δ����ש��ɫ���� | ��֤X�ṹ�в�����ȩ�� |
| B | �ڻ����������ӵı��еμ�������ˮ���������� | ��ȥ���������ı��� |
| C | ��������NaOH��Һ���������ٷֲ㣬��ȴ���ϡ���������ԣ��ٵμ�AgNO3��Һ | ��֤±��ԭ��Ϊ��ԭ�� |
| D | ���Ҵ���Ũ���Ṳ���Ƶõ�����ͨ������KMnO4��Һ�� | ���������к�����ϩ |
| A�� | A | B�� | B | C�� | C | D�� | D |
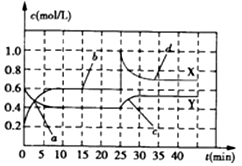
| A�� | ǰ10min����NO2��ʾ�Ļ�ѧ��Ӧ����v��NO2��=0.02mol/��L•min�� | |
| B�� | ��Ӧ������25minʱ�����߷����仯��ԭ�������������������NO2��g�� | |
| C�� | ��Ҫ�ﵽ�������ͬ�Ļ�ѧƽ��״̬����25minʱ�����Բ�ȡ�Ĵ�ʩ������N2O4��g�� | |
| D�� | a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬�ĵ����b��d |
��֪���ټ������ʵ��ܽ�ȣ�g/100gH2O�������ʾ��
| FeSO4•7H2O | ��NH4��2SO4 | FeSO4•��NH4��2SO4•6H2O | |
| 20�� | 48 | 75 | 37 |
| 60�� | 101 | 88 | 38 |
��ش�
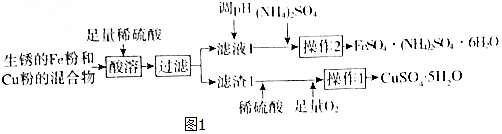
��1���������õ���Ҫ��������Ϊ��������©�����ձ���
��2����Һ1�е���Ҫ����ΪFeSO4��H2SO4���ѧʽ����
��3�����в���2ʱ������Һ���������������ȹ��ˣ�ԭ��Ϊ��С��������������淋�����ʹ��FeSO4•��NH4��2SO4•6H2O���������
��4��FeSO4•��NH4��2SO4•6H2O������ϡ����ϴ�ӣ���������ˮϴ�ӵ�ԭ��Ϊ�����������Ӻ�笠����ӵ�ˮ�⣬��ֹ�������ӱ�������
��5����ȡ2.50gCuSO4•5H2O��Ʒ�����չ�������Ʒ�������¶ȣ�T���仯��������ͼ2��ʾ��
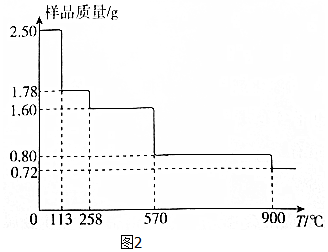
��120�����Ĺ��壬����������258��ʱʧˮ����������Ӧ�Ļ�ѧ����ʽΪCuSO4•H2O$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+H2O��
��900��ʱʣ�����ֻ��һ��ͭ��������仯ѧʽΪCu2O��