题目内容
16.某温度下,在密闭容器中进行SO2的催化氧化反应.若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是( )| A. | SO2的转化率为60% | |
| B. | SO3的产率为60% | |
| C. | 平衡时总压强与起始压强之比为7:8 | |
| D. | 平衡时V(SO2):V(O2):V(SO3)=3:3:1 |
分析 若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+O2?2SO3,
开始 6 6 0
转化 3 1.5 3
平衡 3 4.5 3
结合转化率=$\frac{转化的量}{开始的量}$×100%及物质的量比等于压强比计算.
解答 解:若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+O2?2SO3,
开始 6 6 0
转化 3 1.5 3
平衡 3 4.5 3
A.SO2的转化率为$\frac{3mol/L}{6mol/L}$=50%,故A错误;
B.理论上完全转化生成SO3的浓度为6mol/L,则产率为$\frac{3mol/L}{6mol/L}$=50%,故B错误;
C.平衡时总压强与起始压强之比为$\frac{3+4.5+3}{6+6}$=7:8,故C正确;
D.平衡时V(SO2):V(O2):V(SO3)=3:4.5:3=2:3:2,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意物质的量与压强的关系,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
6.关于100mL 1mol/LCaCl2溶液的叙述正确的是( )
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
7.下述实验能达到预期目的是编号( )
| 实验内容 | 实验目的 | |
| A | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热煮沸后未出现砖红色沉淀 | 验证X结构中不含有醛基 |
| B | 在混有少量苯酚的苯中滴加足量溴水,充分振荡后过滤 | 除去苯中少量的苯酚 |
| C | 溴乙烷与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加AgNO3溶液 | 验证卤素原子为溴原子 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A. | A | B. | B | C. | C | D. | D |
4.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )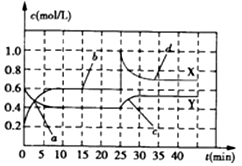

| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
11.下列叙述正确的是( )
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
1.有关下列图象的分析错误的是( )
| A. |  图可表示对平衡N2(g)+3H2(g)?2NH3(g)加压、同时移除部分NH3时的速率变化 | |
| B. |  图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 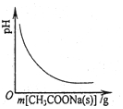 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| D. | 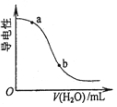 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b |
4.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
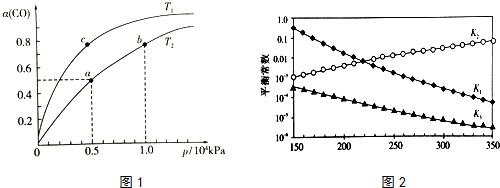
①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
1.工业上用生锈的Fe粉和Cu粉的混合物制备CuSO4•5H2O和FeSO4•(NH4)2SO4•6H2O的工艺流程如图1所示.
已知:①几种物质的溶解度(g/100gH2O)如表所示.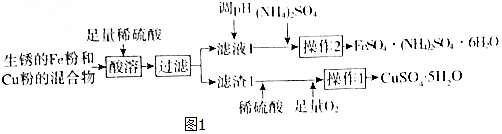
②溶液pH>4时,Fe2+容易被氧化.
请回答:
(1)过滤所用的主要玻璃仪器为玻璃棒、漏斗、烧杯.
(2)溶液1中的主要溶质为FeSO4、H2SO4(填化学式).
(3)进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯.
(4)FeSO4•(NH4)2SO4•6H2O用适量稀硫酸洗涤,而不是用水洗涤的原因为抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化.
(5)称取2.50gCuSO4•5H2O样品,灼烧过程中样品质量随温度(T)变化的曲线如图2所示.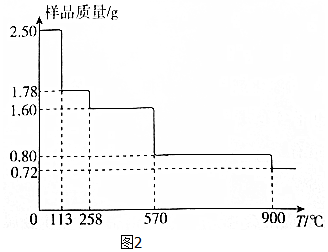
①120℃所的固体,继续加热至258℃时失水,所发生反应的化学方程式为CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O.
②900℃时剩余固体只有一种铜的氧化物,其化学式为Cu2O.
已知:①几种物质的溶解度(g/100gH2O)如表所示.

| FeSO4•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
请回答:
(1)过滤所用的主要玻璃仪器为玻璃棒、漏斗、烧杯.
(2)溶液1中的主要溶质为FeSO4、H2SO4(填化学式).
(3)进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为减小硫酸亚铁和硫酸铵的析出使得FeSO4•(NH4)2SO4•6H2O晶体更纯.
(4)FeSO4•(NH4)2SO4•6H2O用适量稀硫酸洗涤,而不是用水洗涤的原因为抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化.
(5)称取2.50gCuSO4•5H2O样品,灼烧过程中样品质量随温度(T)变化的曲线如图2所示.

①120℃所的固体,继续加热至258℃时失水,所发生反应的化学方程式为CuSO4•H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O.
②900℃时剩余固体只有一种铜的氧化物,其化学式为Cu2O.
2.体积为VmL,密度为ρg•mL-1的含有相对分子质量为M的某种物质(不含结晶水)的溶液,其中溶质为mg,其物质的量浓度为C mol/L,溶质的质量分数为W%,则下列表示正确的是( )
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |