题目内容
19.下列说法错误的是( )| A. | S(g)+O2(g)=SO2(g)△H3S(s)+O2(g)=SO2(g)△H2,则△H1<△H2 | |
| B. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,则反应总能量>生成物总能量 | |
| C. | 己知C(石墨•s)=C(金刚石•s)△H>0,则石墨比金刚石稳定 | |
| D. | 相同条件下,如果1mol氢原子所具有的能量为E1•1mol氢分子所具有的能量为E2,则2E1=E2 |
分析 A.都为放热反应,固体燃烧放出的热量小于气体燃烧放出的热量;
B.为放热反应,反应物总能量大于生成物总能量;
C.能量越高越不稳定;
D.根据形成化学键放出能量判断.
解答 解:A.都为放热反应,固体燃烧放出的热量小于气体燃烧放出的热量,△H<0,则放出的热量越多△H越小,故A正确;
B.为放热反应,反应物总能量大于生成物总能量,故B正确;
C.C(石墨•s)=C(金刚石•s)△H>0,可知金刚石的总能量高,能量越高越不稳定,故C正确;
D.因形成化学键放出能量,则2E1>E2,故D错误.
故选D.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力的考查,解答本题时注意把握比较反应热的角度,难度不大.

练习册系列答案
相关题目
9.汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO、NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H大于0
目前,在汽车尾气系统中装置催化转化器可以减少CO、NO的污染,其化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是减少CO2浓度;若升高温度,NO浓度将减小(填“增大”、“不变”或“减小”).
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)?2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO、NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H大于0
目前,在汽车尾气系统中装置催化转化器可以减少CO、NO的污染,其化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)?N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
10.常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
| A. | 13:8:27 | B. | 13:9:27 | C. | 26:16:27 | D. | 286:8:27 |
7.下述实验能达到预期目的是编号( )
| 实验内容 | 实验目的 | |
| A | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热煮沸后未出现砖红色沉淀 | 验证X结构中不含有醛基 |
| B | 在混有少量苯酚的苯中滴加足量溴水,充分振荡后过滤 | 除去苯中少量的苯酚 |
| C | 溴乙烷与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加AgNO3溶液 | 验证卤素原子为溴原子 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A. | A | B. | B | C. | C | D. | D |
4.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )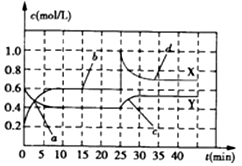

| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
11.下列叙述正确的是( )
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
4.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
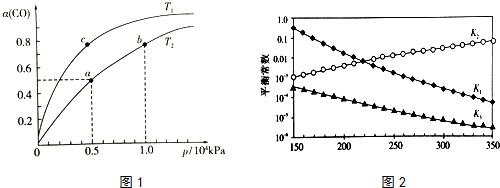
①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.

①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
5.运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
(1)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为11.2L.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式2H++SO42-+Ba2++2OH-=BaSO4+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c(SO{\;}_{3}{\;}^{2-})c(H{\;}^{+})}{c(HSO{\;}_{3}{\;}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为11.2L.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式2H++SO42-+Ba2++2OH-=BaSO4+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
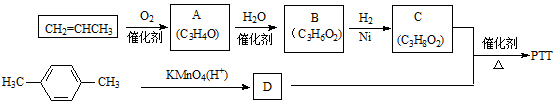

 ,反应类型为
,反应类型为