题目内容
1. 某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:
某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:(1)装置A中发生反应的化学方程式为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)①装置B的作用是贮存多系的气体,B中应放置的液体是:d(填序号).
a.饱和Na2CO3溶液 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
(3)实验中,某学生向A中反应后的溶液中边加热边通入一种常见气体单质,使剩余的铜片全部溶解,且仅生成硫酸铜溶液,该反应的化学方程式是:2Cu+2H2SO4+O2=2CuSO4+2H2O.
(4)为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别按以下方案进行如下实验:
方案I:向第一份溶滚中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是:Ⅲ(填“Ⅰ”、“Ⅱ”或“Ⅲ”)通入二氧化硫时,C中发生反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
(5)D中盛有氢氧化钠溶液,当少量的SO2尾气通入D中时,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
(6)利用FeCl3溶液的氧化性也可以吸收SO2,该反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
检验FeCl3是否完全被还原的方法为(用适当的文字描述):取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
分析 A装置:Cu与浓硫酸加热反应生成二氧化硫气体,装置B:贮存多余二氧化硫,二氧化硫具有还原性,C中盛有氯水,装置C:验证二氧化硫的还原性,二氧化硫为酸性气体,装置D:盛有氢氧化钠溶液,吸收SO2尾气.
(1)Cu与浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(2)①根据装置B的作用是“贮存多余的二氧化硫”,所以B中盛放的液体不能使二氧化硫的量减少,据此进行判断;
②反应后剩余的酸为硫酸,溶液中还有硫酸铜,利用与氢离子的反应进行检验;
(3)向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,通入的气体具有氧化性,根据元素守恒可知,应通入氧气;
(4)氯水与二氧化硫反应生成HCl与硫酸,检验反应后溶液中含有SO42-,说明二氧化硫具有还原性,氯水溶液中含有氯离子,能与硝酸银生成白色沉淀,氯水中含有HClO,可以使品红溶液褪色;
(5)二氧化硫和过量氢氧化钠反应生成亚硫酸钠;
(6)二氧化硫具有还原性,铁离子具有氧化性,两者反应生成亚铁离子,据此书写离子方程式,Fe2+与KSCN不反应,Fe3+与KSCN结合生成络离子,溶液为血红色.
解答 解:(1)装置A中圆底烧瓶盛放Cu,分液漏斗中盛放浓硫酸,铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)①装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体不能导致二氧化硫减少,亚硫酸的酸性强于碳酸,二氧化硫通过饱和Na2CO3溶液,生成二氧化碳,二氧化硫具有还原性,在溶液中可以被酸性高锰酸钾、溴水氧化,与亚硫酸氢钠不反应,
故选:d;
②反应后剩余的酸为硫酸,溶液中还有硫酸铜,利用与氢离子的反应进行检验,Fe、CuO、碳酸钠能与硫酸反应,氯化钡与硫酸、硫酸铜均可反应生白色沉淀,不能证明反应结束后的烧瓶中的确有余酸,
故选:b;
(3)向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,通入的气体具有氧化性,根据元素守恒可知,应通入氧气,反应方程式为:2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2=2CuSO4+2H2O;
(4)氯水与二氧化硫反应生成HCl与硫酸,检验反应后溶液中含有SO42-,说明二氧化硫具有还原性,
氯水溶液中含有氯离子,能与硝酸银生成白色沉淀,方案I不合理,
氯水中含有HClO,可以使品红溶液褪色,不能说明二氧化硫还原性,方案Ⅱ不合理,
向第三份溶液加入BaCl2溶液,产生白色沉淀,说明生成SO42-,方案Ⅲ合理,
C中发生反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42-,
故答案为:Ⅲ;Cl2+SO2+2H2O=4H++2Cl-+SO42-;
(5)少量二氧化硫和NaOH反应生成亚硫酸钠和水,离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(6)在溶液中铁离子将二氧化硫氧化为硫酸,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;Fe3++3SCN-=Fe(SCN)3,现象是生成血红色溶液,检验FeCl3是否完全被还原的方法为:取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;取少量反应后的溶液滴加少量硫氰化钾溶液,若不变红则氯化铁完全被还原.
点评 本题考查探究铜与浓硫酸的反应实验,侧重考查学生的分析能力和实验能力,熟练掌握元素化合物性质,明确反应原理、二氧化硫的性质是解答本题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 放电时负极:Cd-2e-═Cd2+ | |
| B. | 放电时正极:2NiOOH+2e-+2H2O═2Ni(OH)2+2OH- | |
| C. | 充电时阳极:2Ni(OH)2-2e-+4H+═2Ni3++4H2O | |
| D. | 充电时含Cd的电极应与电源的正极相连 |
| A. | 17g NH3所含的电子数是17NA | |
| B. | 32 g O3中含有氧原子的个数为2NA | |
| C. | 5.6gFe与足量盐酸完全反应,Fe失去的电子数为0.3NA | |
| D. | 标准状况下,11.2 LH2O中含有O-H键的数目为NA |
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | C 既是氧化剂又是还原剂 | |
| D. | 若生成4.48L CO,则转移0.4 mol 电子 |
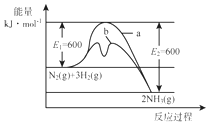 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
| A. | 工业上利用铝热反应炼铁 | |
| B. | 将Mg、Al用导线连接并插入NaOH溶液中,判断Mg、Al金属性强弱 | |
| C. | 将CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀 | |
| D. | 实验室利用锌片和稀硫酸制H2时,为了加快制H2的反应速率可加入Cu(NO3)2 |
| A. | Cu、Fe、Ag | B. | Cl、Br、I | C. | Na、Cu、Hg | D. | F、Br、I |
 下列气体中,在实验室能用如图所示的装置制取并收集的是( )
下列气体中,在实验室能用如图所示的装置制取并收集的是( )| A. | H2 | B. | NH3 | C. | O2 | D. | CO2 |