题目内容
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 17g NH3所含的电子数是17NA | |
| B. | 32 g O3中含有氧原子的个数为2NA | |
| C. | 5.6gFe与足量盐酸完全反应,Fe失去的电子数为0.3NA | |
| D. | 标准状况下,11.2 LH2O中含有O-H键的数目为NA |
分析 A.氨气分子中含有11个电子,17g氨气的物质的量为1mol,含有10mol电子;
B.根据n=$\frac{m}{M}$计算出臭氧中含有氧原子的物质的量,然后可计算出含有氧原子的数目;
C.铁与盐酸反应生成的是亚铁离子;
D.标况下水的状态不是气态.
解答 解:A.17g NH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有10mol电子,含有的电子数是10NA,故A错误;
B.32 g O3中含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,含有氧原子个数为2NA,故B正确;
C.5.6gFe的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1molFe与足量盐酸完全反应生成0.1mol氯化亚铁,Fe失去0.2mol电子,铁失去的电子数为0.2NA,故C错误;
D.标准状况下水不是气体,不能使用标况下的气体摩尔体积计算,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
19.某种氢氧燃料电池的电解质溶液为KOH溶液.下列有关该电池的叙述不正确的是( )
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应式为:2H2+O2═2H2O | |
| D. | 该电池工作时每消耗1molO2,有2mol电子转移 |
17.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
4.工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂.但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L.某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如图,夹持仪器省略.
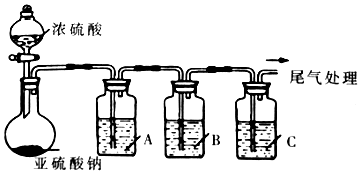
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
②A中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-.
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.

(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.
14.下列各图水槽中盛装的是海水,其中铁被腐蚀的最快的是( )
| A. |  | B. |  | C. |  | D. |  |
6.能证明某溶液中含有氯化钠的是( )
| A. | 焰色反应是黄色 | |
| B. | 溶液有咸味 | |
| C. | 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀 | |
| D. | 既出现A中的现象,又出现C中的现象 |

 某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题:
某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用右图所示装置进行有关实验.请回答下列问题: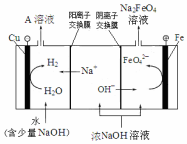 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.