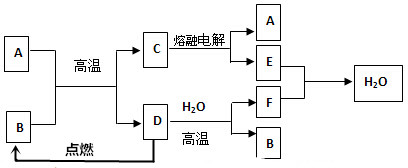
题目内容
12.下列除去杂质(括号的物质为杂质)的方法中,正确的是( )| A. | FeCl2溶液(FeCl3):加入过量Cu后过滤 | |
| B. | Na2CO3固体(NaHCO3):加热 | |
| C. | CH3COOCH2CH3(CH3COOH):加NaOH溶液后振荡、分液 | |
| D. | Cl2(HCl):通过NaOH溶液后干燥 |
分析 A.Cu与氯化铁反应生成氯化铜、氯化亚铁;
B.碳酸氢钠加热分解生成碳酸钠;
C.二者均与NaOH反应;
D.二者均与NaOH溶液反应.
解答 解:A.Cu与氯化铁反应生成氯化铜、氯化亚铁,引入新杂质氯化铜,应选足量铁粉、过滤,故A错误;
B.碳酸氢钠加热分解生成碳酸钠,则加热可除杂,故B正确;
C.二者均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液,故C错误;
D.二者均与NaOH溶液反应,不能除杂,应选饱和食盐水、洗气,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列混合物无论总质量或总物质的量一定,完全燃烧生成二氧化碳、水的量都一定的是( )
| A. | 甲烷和甲醇 | B. | 丙醛和丙酮 | C. | 乙烯和乙炔 | D. | 乙烯和乙醇 |
7.丁烷催化裂化时碳碳键按两种方式断裂,生成两种烷烃和两种烯烃.如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为( )
| A. | 18.75% | B. | 30% | C. | 15% | D. | 22.5% |
17.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍.下列说法中正确的是( )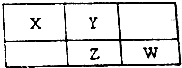

| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
7.下列说法正确的是( )
| A. | 常温下,在某弱酸HA溶液中加入NaA固体后,$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 常温下,0.1 mol•L-1的NH4HCO3溶液其pH=7.8,则Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | 已知常温低下Ksp(AgI)=2.0×10-16,在AgI悬浊液中加入少量KI粉末,AgI(s)?Ag+(aq)+I-(aq)平衡向左移动,溶液中离子的总浓度会减小 |
4.实验室使用pH传感器来测定Na2CO3和NaHCO3混合溶液中NaHCO3的含量.取该混合溶液25.00mL,用0.1mol•L-1盐酸进行滴定,得到如下曲线.以下说法正确的是( )
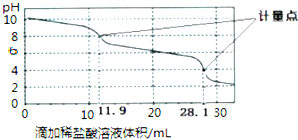

| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
5.下列说法正确的是( )
| A. | 2.0 g H218O与2H2O的混合物中所含中子数约为6.02×1023 | |
| B. | 2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,说明该反应的△H<0 | |
| C. | 向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清,说明苯酚的酸性强于碳酸 |