题目内容
5.下列说法正确的是( )| A. | 2.0 g H218O与2H2O的混合物中所含中子数约为6.02×1023 | |
| B. | 2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,说明该反应的△H<0 | |
| C. | 向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清,说明苯酚的酸性强于碳酸 |
分析 A.H218O摩尔质量为20g/mol,2H2O摩尔质量为20g/mol,H218O分子中中子数=1-1+18-8=10,2H2O分子中中子数=(2-1)×2+16-8=10,则就是物质的量得到中子数分析判断;
B.反应自发进行的判断依据△H-T△S<0;
C.沉淀生成是在温度一定条件下,离子浓度乘积符合溶度积常数的原因;
D.苯酚和碳酸钠反应生成可溶性的碳酸氢钠和苯酚钠;
解答 解:A.H218O摩尔质量为20g/mol,2H2O摩尔质量为20g/mol,H218O分子中中子数=1-1+18-8=10,2H2O分子中中子数=(2-1)×2+16-8=10,2.0 g H218O与2H2O的混合物物质的量=$\frac{2.0g}{20g/mol}$=0.1mol,混合物中所含中子数=0.1mol×10×6.02×1023=为6.02×1023,故A正确;
B.2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,△H-T△S<0,反应前后气体体积减小△S<0,则△H一定大于0,故B错误;
C.BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为碳酸根离子浓度和钡离子浓度乘积大于溶度积常数,Ksp(BaSO4)小于Ksp(BaCO3),故C错误;
D.C6H5OH+Na2CO3→C6H5ONa+NaHCO3,苯酚钠和碳酸氢钠都是易溶性物质,所以溶液变澄清,说明酸性苯酚>碳酸氢根离子,故D错误;
故选A.
点评 本题考查了微粒数目与物质的量的计算、反应自发进行的判断依据、沉淀溶解平衡的理解应用、酸性强弱的比较等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列除去杂质(括号的物质为杂质)的方法中,正确的是( )
| A. | FeCl2溶液(FeCl3):加入过量Cu后过滤 | |
| B. | Na2CO3固体(NaHCO3):加热 | |
| C. | CH3COOCH2CH3(CH3COOH):加NaOH溶液后振荡、分液 | |
| D. | Cl2(HCl):通过NaOH溶液后干燥 |
16.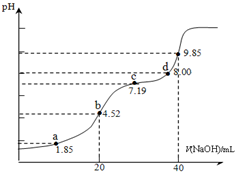 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
13.中国传统文化对人类文明贡献巨大,古文献中充分记载了古代化学研究成果,下列关于KNO3的古代文献,对其说明不合理的是( )
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
20.铅及其化合物在生产及生活中都具有非常广泛的用途.
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
①该还原反应的△H<0(填“>”、“<”或“=”).
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
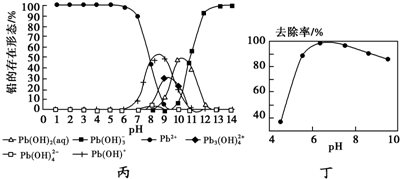
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.
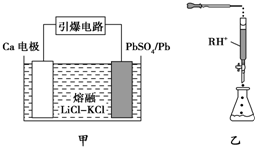
(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.
①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.

(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.

①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
10.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 火箭用偏二甲肼(C2H8N2)作燃料,N2O4作还原剂,反应产生巨大能量 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 硫是一种生命元素,自然界中的石膏矿、硫铁矿、赤铁矿等都是含“硫”为主的矿石 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
14.利用如图所示装置及表中的试剂,能达到相应实验目的是( )
| 选项 | 试剂甲 | 试剂乙 | 实验目的 | 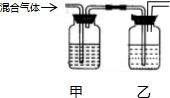 |
| A | NaOH溶液 | 浓硫酸 | 从等体积NO、NH3和NO2中分离出NO | |
| B | KMnO4溶液 | 浓硫酸 | 除去Cl2中的SO2、HCl得干燥Cl2 | |
| C | 溴水 | 浓H2SO4 | 除去乙炔中的H2S和H2O(g) | |
| D | 品红溶液 | 石灰水 | 检验混合气体HCl、SO2、CO2中的SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
 .
.
 .
. .
.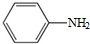 )易被氧化
)易被氧化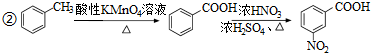
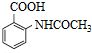 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).