题目内容
20.如图所示: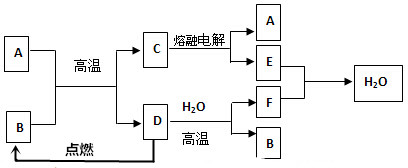
已知A、D、E、F是中学化学中常见单质,B、C是氧化物.请填空:
(1)A是Al,E是O2(填化学式);
(2)D跟水反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)C电解的化学方程式是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;每生成lmolA同时生成0.75molE;
(4)先将B溶于足量盐酸,再向用盐酸溶解后的溶液中通入足量Cl2,请写出此过程中有关反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
分析 A、D、E、F是中学化学中常见单质,B、C是氧化物,则A与B发生的为铝热反应,C电解生成A,可知A为Al,C为Al2O3,E为O2,结合D燃烧及D与水蒸气反应,可知D为Fe,B为Fe3O4,F为H2,以此来解答.
解答 解:A、D、E、F是中学化学中常见单质,B、C是氧化物,则A与B发生的为铝热反应,C电解生成A,可知A为Al,C为Al2O3,E为O2,结合D燃烧及D与水蒸气反应,可知D为Fe,B为Fe3O4,F为H2,
(1)由上述分析可知,A为Al,E为O2,故答案为:Al;O2;
(2)D跟水反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)C电解的化学方程式是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;由反应可知,每生成lmolA同时生成0.75molE,故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;0.75;
(4)先将B溶于足量盐酸,溶液中含亚铁离子、铁离子,再向用盐酸溶解后的溶液中通入足量Cl2,有关反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物的推断,为高频考点,把握铝热反应和Al、Fe及其化合物的性质为解答的关键,侧重分析与推断能力的考查,注意铝热反应及电解法冶炼Al为推断的突破口,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.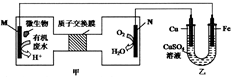 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
8.某实验小组为测定某石灰石中CaCO3的质量分数,先称取W g石灰石样品,加入过量的浓度为6mol•L-1的盐酸,使样品完全溶解,加热煮沸后,除去溶解的CO2,再向溶液中加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀:C2O42-+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀H2SO4溶解:CaC2O4+H2SO4=H2C2O4+CaSO4,再用蒸馏水稀释溶液至V0 mL.取出V1 mL,用a mol•L-1的KMnO4酸性溶液进行滴定,此时发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,若滴定终点时消耗a mol•L-1的KMnO4溶液V2 mL,则样品中CaCO3的质量分数为( )
| A. | $\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$% | B. | $\frac{25a{V}_{1}{V}_{2}}{W{V}_{0}}$% | C. | $\frac{25a{V}_{1}{V}_{0}}{W{V}_{2}}$% | D. | $\frac{25a{V}_{2}}{W}$% |
15.滴定分析法按反应类型一般可以分为__类.( )
| A. | 二 | B. | 一 | C. | 四 | D. | 三 |
5.已知某链状高分子化合物结构简式为: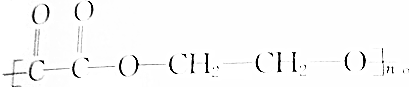 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
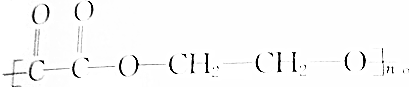 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )| A. | 2mol | B. | 4mol | C. | 2nmol | D. | 4nmol |
12.下列除去杂质(括号的物质为杂质)的方法中,正确的是( )
| A. | FeCl2溶液(FeCl3):加入过量Cu后过滤 | |
| B. | Na2CO3固体(NaHCO3):加热 | |
| C. | CH3COOCH2CH3(CH3COOH):加NaOH溶液后振荡、分液 | |
| D. | Cl2(HCl):通过NaOH溶液后干燥 |
12.X、Y、Z、W为元素周期表中前20号元素,原子序数依次增大、W、Y为金属元素,X原子的最外层电子数是其核外电子数总数的$\frac{3}{4}$倍;Z单质是制造太阳能电池的主要材料之一;Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是( )
| A. | 最外层电子数:W>Z | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最高价氧化物对应水物的碱性:Y<W | D. | Y、Z的氧化物都是两性氧化物 |
13.中国传统文化对人类文明贡献巨大,古文献中充分记载了古代化学研究成果,下列关于KNO3的古代文献,对其说明不合理的是( )
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
