题目内容
2.A、B、C、D、E、F、G、H各物质间的转化关系如图所示,已知A、D是地壳中含量最多的两种金属元素的单质,其余均为化合物,G遇KSCN溶液呈血红色.回答下列问题: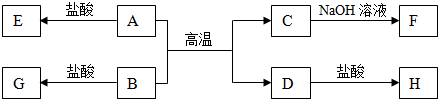
(1)C的化学式为Al2O3;A的原子结构示意图为
 .
.(2)写出D到H的离子方程式Fe+2H+=Fe2++H2↑.
(3)向G溶液中加入D物质的离子方程式2Fe3++Fe═3Fe2+.
(4)工业上由C制取A的化学方程式2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(5)向1mol E的溶液中加入4 mol NaOH也可全部转化为F溶液.
(6)写出A与B生成C与D的反应在工业上的一点用途焊接钢轨.
分析 A、D为单质,其余均为化合物,A、D是地壳中含量最多的两种金属元素的单质,分别为Al、Fe中的一种,A与B反应得到C与D,则A为Al、D为Fe,B与盐酸反应得到G,G遇KSCN溶液呈血红色,则G为FeCl3,B为Fe2O3,C为Al2O3,C与氢氧化钠反应得到F为NaAlO2,Fe与盐酸反应得到H为FeCl2,Al与盐酸反应得到E为AlCl3,据此解答.
解答 解:A、D为单质,其余均为化合物,A、D是地壳中含量最多的两种金属元素的单质,分别为Al、Fe中的一种,A与B反应得到C与D,则A为Al、D为Fe,B与盐酸反应得到G,G遇KSCN溶液呈血红色,则G为FeCl3,B为Fe2O3,C为Al2O3,C与氢氧化钠反应得到F为NaAlO2,Fe与盐酸反应得到H为FeCl2,Al与盐酸反应得到E为AlCl3.
(1)C的化学式为Al2O3,A为Al,原子结构示意图为 ,故答案为:Al2O3;
,故答案为:Al2O3; ;
;
(2)D到H的离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)向G溶液中加入D物质的离子方程式:2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(4)工业上由C制取A的化学方程式:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(5)由AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,可知向1mol AlCl3的溶液中加入4 mol NaOH也可全部转化为NaAlO2溶液,故答案为:4;
(6)A与B生成C与D是铝热反应,该反应在工业上可以进行焊接钢轨,故答案为:焊接钢轨.
点评 本题考查无机物的推断,涉及Fe、Al元素化合物性质与转化,需要学生熟练掌握元素化合物知识,难度中等.

 阅读快车系列答案
阅读快车系列答案(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ/mol
则ZnO(s)+2Ag(s)═Zn(s)+Ag2O(s)的△H等于( )
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c(OH-)=1×10-14mol•L-1溶液:K+、Na+、Cl-、HCO3- |
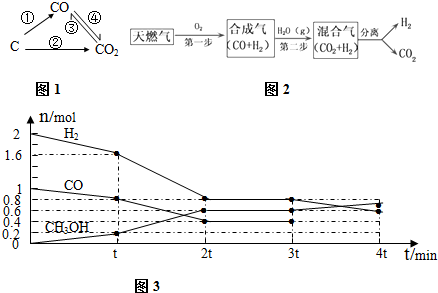
(1)图1为碳及其氧化物的变化关系图,若①变化是置换反应则其化学方程式可为(写一个即可)C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO;写出实验室检验CO2气体的离子反应方程式:①③
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2?CO(g)降低其浓度.某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
| 容器编号 | c(CO)/mol.L-1 | c(O2)/mol.L-1 | (CO2)/mol.L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72kJ•mol-1.
(4)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(3)转化中得到的合成气制备甲醇.反应为CO(g)+2H2(g)?CH3OH(g) 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图3:
①根据图3计算,从反应开始到t min时,用H2浓度变化表示的平均反应速率v(H2)=$\frac{1}{5t}$mol/(L•min)
②t min至2t min时速率变化的原因可能是反应受热或使用了催化剂;
③3t min时对反应体系改变了一个条件,至4t min时CO的物质的量为0.5mol,
请画出图3中3tmin 到4t min内CO的物质的量随时间变化的曲线.
(5)某同学按图所示的装置用甲醇燃料电池(装置I)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL 0.4mol/L硫酸铜溶、液.当装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8).
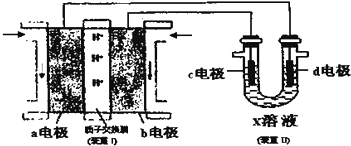
①装置I中、H+向a极(填“a”或“b”)移动;b电极上发生的反应为CH3OH-6eˉ+H2O=CO2+6H+.
②铜的相对原子质量的表达式为$\frac{11200m}{{V}_{1}}$ (用m和V1的代数式表示).
| A. | Na2O+H2O=2NaOH | B. | Zn+H2SO4=ZnSO4+H2↑ | ||
| C. | 2Na+Cl2=2NaCl | D. | Cl2+2KI=2KCl+I2 |

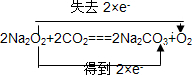 .
.