题目内容
11.4.6g金属钠投入到100g水中,所得溶液的密度为1g•mL-1.(1)生成的气体在标准状况下的体积为2240mL.
(2)列式计算所得溶液的物质的量浓度2mol/L.
分析 根据n=$\frac{m}{M}$计算4.6g金属钠的物质的量,根据方程式计算生成氢气的物质的量、生成NaOH的物质的量,
(1)根据V=nVm计算氢气的体积;
(2)根据c=$\frac{n}{V}$计算氢氧化钠溶液的浓度.
解答 解:4.6g金属钠的物质的量为$\frac{4.6g}{23g/mol}$=0.2mol,则:
2Na+2H2O=2NaOH+H2↑
2 2 1
0.2mol n(NaOH) n(H2)
所以n(NaOH)=0.2mol,n(H2)=0.1mol
(1)生成氢气的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2240;
(2)所得NaOH溶液的物质的浓度是$\frac{0.2mol}{\frac{4.6g+100g-0.1mol×2g/mol}{1g/ml}×0.001L/ml}$=1.91mol/L,故答案为:2mol/L.
点评 本题主要考查根据方程式进行的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,清楚发生的反应是关键.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
19.将8g铁片放入100mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,铁片变为8.2g,则原c(CuSO4)为( )
| A. | 0.25 mol•L-1 | B. | 0.025 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.125 mol•L-1 |
6.下列离子方程式正确的是( )
| A. | 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝2I-+H2O2+2H+═I2+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| C. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| D. | 在AgCl饱和溶液在加入Na2S:2Ag++S2-═Ag2S↓ |
3.下列反应符合图示的是( )
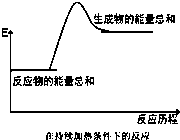

| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 实验室制取氢气 |
17.现有A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Cu(NO3)2和Ba(OH)2溶液中一种.为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示.表中“↓”表示生成沉淀或微溶物,“-”表示观察不到明显变化.
试写出有关物质的化学式:A:KCl,C:MgCl2,E:Cu(NO3)2,G:AgNO3.
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | - | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | - | ↓ | - | ↓ | ↓ | ↓ |
| E | - | - | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
 .
. .
.