题目内容
1.将溴水和苯混合振荡,静置后分液分离,把分离出的苯置于一试管中,加入某些物质后可以在试管口产生白雾,这种物质是( )| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
分析 将苯与溴水混合,充分振荡后静置,发生萃取,溴和苯在上层,溴和苯发生取代反应需要铁或溴化铁作催化剂.
解答 解:将苯与溴水混合,充分振荡后静置,发生萃取,溴和苯在上层,分液后得到溴和苯的混合物,在铁或溴化铁的催化下,发生生成溴苯和溴化氢,溴化氢遇水蒸汽产生白雾,故选BD.
点评 本题考查了苯的取代反应,注意溴和苯取代反应的条件.

练习册系列答案
相关题目
12.碱式碳酸钴[Cox(OH)y(CO3)z常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
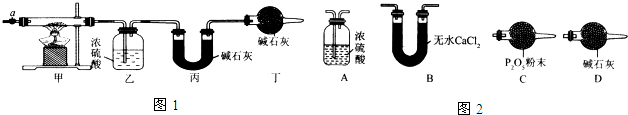
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如表数据.
则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(5)含有Co(AlO2)2 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取 CoCl2•6H2O的一种工艺如图3:
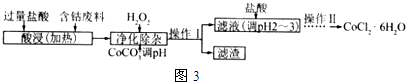
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3、Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如表数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取 CoCl2•6H2O的一种工艺如图3:

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3、Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
16.氮有多种化合价,其常见氧化物有NO、N2O3、NO2、N2O4,其含氧酸有HNO2、HNO3,属于酸性氧化物的是( )
| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
6.W、X、Y、Z均为短周期主族元素,原子序数依次增加,W元素的周期序数、族序数均相等,X、Y、Z的最外层电子数分别为6、2、6.下列说怯正确的是( )
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
9.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:
已知:
①MnO4-在酸性环境下的还原产物是Mn2+
实验用品:仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4•2H2O)1.3 g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如表所示:
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是:秒表.
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③同学测出的颜色变化的时间是以下列哪个选项为依据的C.
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是Mn2+离子在反应中起到催化剂的作用,加快了反应速率.于是甲同学得出结论在其它条件不变的情况下,加入催化剂可加快化学反应速率.
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I该反应是放热反应,温度升高,反应速率增大,溶液褪色加快 II加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应.
已知:
①MnO4-在酸性环境下的还原产物是Mn2+
实验用品:仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4•2H2O)1.3 g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如表所示:
| 试管1 | 试管2 | |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
①甲同学进行该实验还缺少的实验仪器是:秒表.
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③同学测出的颜色变化的时间是以下列哪个选项为依据的C.
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是Mn2+离子在反应中起到催化剂的作用,加快了反应速率.于是甲同学得出结论在其它条件不变的情况下,加入催化剂可加快化学反应速率.
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I该反应是放热反应,温度升高,反应速率增大,溶液褪色加快 II加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应.
10.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | H2+CuO═Cu+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | H2+Cl2═2HCl | D. | 2NaOH+Cl2═NaCl+NaClO+H2O |
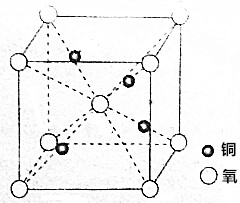 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.