题目内容
11.重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图.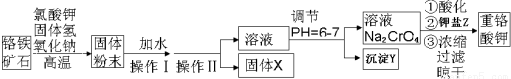
请回答下列问题.
(1)FeO•Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式为6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O.若有245g KClO3 参加反应,则转移的电子数为12mol.
(2)操作Ⅱ的名称是过滤.固体X的主要成分是,沉淀Y的主要成分是Al(OH)3、H2SiO3.
(3)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)C,
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸钾 D.次氯酸和次氯酸钾
酸化反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O.
(4)称取制得的K2Cr2O7晶体2.5000g 配成250mL 溶液,取出25.00mL 于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL 水,加入3mL 淀粉指示剂,用0.1200mol/LNa2S2O3 标准溶液滴定(I2+2S2O32-=2I-+S4O62- ).
①判断达到滴定终点的依据是:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化.
②若实验中共用去Na2S2O3 标准溶液40.00mL,计算所得产品中的重铬酸钾的纯度(设整个过程中其他杂质不参与反应)94.08%.
分析 由制备流程可知,高温下发生6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7HCl+12H2O,固体加水,Fe2O3不溶于水,SiO2、Al2O3与NaOH反应而溶解,则操作I为溶解,操作Ⅱ为过滤,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,Na2CrO4溶液在酸性溶液中反应生成K2Cr2O7,浓缩、结晶、过滤、干燥得到K2Cr2O7固体,以此来解答.
解答 解:由制备流程可知,高温下发生6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7HCl+12H2O,固体加水,Fe2O3不溶于水,SiO2、Al2O3与NaOH反应而溶解,则操作I为溶解,操作Ⅱ为过滤,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,Na2CrO4溶液在酸性溶液中反应生成K2Cr2O7,浓缩、结晶、过滤、干燥得到K2Cr2O7固体,
(1)FeO•Cr2O3与氯酸钾、氢氧化钠高温反应方程式为6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,反应中每7mol氯酸钾参加反应转移42mol电子,所以若有245g 即2molKClO3 参加反应,则转移的电子数为12mol,
故答案为:6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O;12mol;
(2)由上述分析可知,操作Ⅱ分离溶液与不溶性固体,名称为过滤,根据上面的分析可知,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,则Y中含Al(OH)3、H2SiO3,
故答案为:过滤;Fe2O3;Al(OH)3、H2SiO3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O,应选硫酸酸化,因为氯离子能被氧化,故选C,
故答案为:C;2CrO42-+2H+?Cr2O72-+H2O;
(4)①达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200mol/L×0.040L
n=0.0008mol
250ml溶液中含有Cr2O72-物质的量为0.0008mol×$\frac{250}{25}$=0.008mol;
所得产品中重铬酸钾纯度=$\frac{0.008mol×294g/mol}{2.500g}$×100%=94.08%,
故答案为:94.08%.
点评 本题以物质的制备流程考查混合物分离提纯的综合应用,为高频考点,涉及流程分析、混合物分离提纯等,把握流程分析及发生的反应为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.

| 实验 | 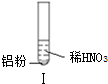 | 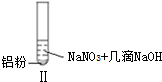 | 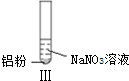 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:
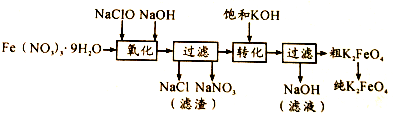
①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
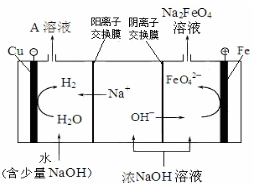
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
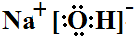 .
.
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38、Ksp[Cu(OH)2]=2.2×10-20,向该温度下含有Fe3+、Cu2+浓度均为0.01mol/L的溶液中,滴加浓NaOH溶液,当溶液pH=10时,溶液中c(Cu2+):c(Fe3+)=5.5×1013:1.
| A. | CO | B. | NH3 | C. | Cl2 | D. | N2 |
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
 CH3COOC2H5+H2O
CH3COOC2H5+H2O ;
;
 .
.